某温度下,在密闭容器里SO2、O2、SO3三种气态物质建立化学平衡后,改变条件,对反应2SO2+O2 2SO3(正反应放热)的正、逆反应速率的影响如图所示。
2SO3(正反应放热)的正、逆反应速率的影响如图所示。
 |
| 正、逆反应速率的变化曲线 |
①加催化剂对速率影响的图象是( )。
②升温对速率影响的图象是( )。
③增大反应容器体积对速率影响的图象是( )。
④增大O2的浓度对速率影响的图象是( )。
(1)有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品。其构想分成3个步骤:
① 利用浓碳酸钾溶液吸收空气中的CO2;
② 将第①步吸收液电解产生H2和O2,同时分离出CO2;
③ 将第②步产生的H2和CO2在一定条件下转化成CH4和水蒸气。
已知:H2(g)+0.5O2(g)=H2O(l) △H1=" —285.8" kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H2=" —889.6" kJ/mol
H2O(l)=H2O(g) △H3=" +44.0" kJ/mol
第③步反应的热化学方程式为。
(2)使用合适的催化剂和电极材料,以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,同时达到固氮作用。该电池的正极反应式为,溶液中H+向极移动(选择填写“正”或“负”)。
(3)某催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高。以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3+C 4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
(4)在T℃时,向2L固定体积的密闭容器中加入4 mol A和2 mol B,发生如下反应:
2A(g) + B(g)  C(g) + D(g) △H =" Q" kJ·mol-1
C(g) + D(g) △H =" Q" kJ·mol-1
当反应达到平衡时,A的转化率为50﹪。
(ⅰ)在一定条件下,反应可以自发向右进行,可知Q __________0 (填“﹤”、“﹥”或“﹦”)。
(ⅱ)维持温度不变,若向该容器中加入的物质及量如下,使起始时v(正)>v(逆)且达到平衡时C的百分含量为20﹪。下列符合要求的是
A.2 mol A、1 mol B B.1 mol He、3 mol A、1.5 mol B、0.5molC、0.5mol D
C.2 mol C、2 mol D D.2 molA、1mol B、1 mol C、1 mol D
锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下: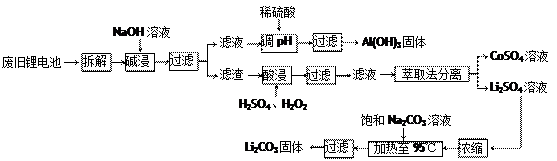
(1)上述工艺回收到的产物有Al (OH)3、。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是。
(3)酸浸时反应的化学方程式为。如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是。
(4)生成Li2CO3的化学反应方程式为。已知Li2CO3在水中的溶解度随着温度的升高而减小,所以在浓缩结晶后要过滤。
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双 氧水反应,生成氮气和水蒸气,放出256.6KJ的热量。
氧水反应,生成氮气和水蒸气,放出256.6KJ的热量。
(1)反应的热化学方程式为。
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是KJ。
(3)肼与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20%---30%的氢氧化钾溶液,写出该电池放电时的电极反应:
正极负极
铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为:PbO2 + Pb + 2H2SO4 ="=" 2PbSO4+ 2H2O,据此判断:
(1)铅蓄电池的负极材料是________。
(2)工作时正极反应为________________________________。
(3)工作时,电解质溶液的PH________(填“增大”、“减小”或“不变”)
(4)工作时,电解质溶液中阴离子移向________极;电流方向从________极流向________极。(填正,负)
下表是元素周期表的一部分,回答下列有关问题
(1)写出下列元素符号:① ________,⑥ ________。
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是________,碱性最强的是________,呈两性的氢氧化物是________。(用化学式表示)
(3)已知⑦的一种单质具有强氧化性,能使淀粉碘化钾式纸变蓝,化学方程式为,
O3+2KI+H2O=2KOH+I2+O2当生成1.27克碘时,转移的电子数为.