共聚法可改进有机高分子化合物的性质,高分子聚合物P的合成路线如下:
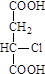

已知:
R—CH2OH R—COOH(R表示饱和烃基)
R—COOH(R表示饱和烃基)
|
R—OH+R′—OH R—O—R′+H2O (R、R′ 表示烃基)
R—O—R′+H2O (R、R′ 表示烃基)



 nCH=CH+nCH=CH
nCH=CH+nCH=CH (R1~R4表示氢或烃基)
(R1~R4表示氢或烃基)
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+、Na+、Al3+、Cu2+ |
| 阴离子 |
OH-、HCO3-、NO3-、SO42- |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀完全溶解;
③进行焰色反应,B、C为紫色(透过蓝色钴玻璃),A、E为黄色;
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀,B中无明显现象。
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、C的化学式:B ; C。
(2)写出过量E滴人到C溶液中的离子反应方程式。
(3)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
(4)在A溶液中加澄清石灰水,其离子方程式为。
(5)上述五种化合物中有一种是常用作净水剂,其净水原理是:(请结合方程式及必要的文字进行叙述)。
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
(2)整个过程中的还原剂是________________。
(3)把KI换成KBr,则CCl4层变成________色,继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是。
(4)加碘盐中含碘量为25.4mg~50 mg/kg。制取加碘盐(含KIO3的食盐)1000 kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2L(标准状况)。
酯化反应是中学有机化学反应中重要的反应之一。如图为乙酸乙酯的制备装置图。a试管中装有适当过量的无水乙醇、2mL浓硫酸和2mL冰醋酸,小心均匀加热(避免副反应)至充分反应。请回答: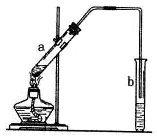
(1)写出反应的化学方程式;
(2)b试管中装的液体通常是,实验时往往在b试管中可以看到少量气泡,写出与此现象对应的离子方程式。
(3)甲同学为了研究该反应机理使用了2H作同位素示踪原子。你认为合理吗?为什么?;
乙同学采用“CH3CH218OH”做该实验,结果含18O原子的产物的结构简式为,乙酸分子中被取代的原子团的电子式为;
(4)浓硫酸在该反应中的作用是催化剂和剂,以此加快反应速率和(用化学平衡知识答题)。
已知:2NO2(g) N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图⑴所示。请回答:
N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图⑴所示。请回答: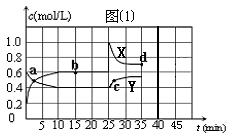
(1)a点时,v(正)v(逆)(填“<”、“>”或“=”),X线、Y线中代表N2O4的是;
(2)反应在第10 min达到平衡,则前10 min内用NO2表示的化学反应速率v(NO2)=mol·L-1·min-1。该温度下,反应的平衡常数K=(可用分数表示);
(3)在第25分钟,进行的操作是;
(4)a、b、c、d四点对应的时刻,NO2物质的量浓度由小到大的顺序是,再次平衡时的d点NO2的体积分数比b点时(填“大”、“小”或“相等”);
(5)假如在第35分钟从容器中移去0.4mol N2O4,并加入适当催化剂使反应在第40分钟达到平衡,请在图⑴中画出从第35分钟以后两种物质的物质的量浓度c随时间t的变化关系,并标注所画线条对应的物质。
已知H2A是一种无机二元酸,请回答以下问题:
(1) 若H2A为二元弱酸,在水溶液中的电离方程式为;
(2) 若NaHA溶液显碱性,则H2A是(填“强酸”、“弱酸”或“无法确定”),原因是。
(3) 若溶液显酸性,在25℃下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1 KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是;
a.c(H+)·c(OH-)=1×10-14 b.c(Na+)+c(K+)=0.1 mol·L-1
c.c(Na+)>c(K+) d.c(Na+)=c(HA-)+c(A2-)