同温同压下,同质量的气体A与B,已知B的体积大于A,则它们相对分子质量的关系是( )
A.Mr(A)>Mr(B) B.Mr(A)<Mr(B) C.Mr(A)=Mr(B) D.无法比较
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只能被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是
| A.混合酸液中NO3-的物质的量为0.4mol |
| B.OA段产生是NO,AB段反应为2Fe3++Fe = 3Fe2+,BC段产生氢气 |
| C.溶液中最终溶质为FeSO4 |
| D.c(H2SO4)为5 mol·L-1 |
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
下表为六种短周期元素的部分性质:下列有关说法错误的是
| 元素代号 |
X |
Y |
Z |
Q |
R |
T |
| 原子半径/10-10m |
0.77 |
0.74 |
0.75 |
1.17 |
0.99 |
1.10 |
| 主要化合价 |
+4、 -4 |
-2 |
+5、 -3 |
+4、 -4 |
+7、 -1 |
+5、 -3 |
A.X与Y可以形成阴离子XY32-
B.元素R的氧化物对应的水化物一定为强酸
C.Z的氢化物的沸点比T的氢化物的沸点高
D.由X形成的化合物XY2和XR4,其中XR4的沸点高
W、X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z- ,Y+和Z-离子具有相同的电子层结构。下列说法正确的是
| A.原子最外层电子数:X>Y>Z | B.单质沸点:X>Y>Z |
| C.原子序数:X>Y>Z | D.离子半径:X2>-Y+>Z- |
根据下图海水综合利用的工业流程图,判断下列说法正确的是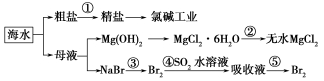
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
| A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 |
| B.在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2 |
| C.从能量角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程 |
| D.从第③步到第④步的目的是为了浓缩富集溴 |