(8分)实验室里用加热正丁醇、溴化钠和浓硫酸的混合物的方法来制备1-溴丁烷时,还会有烯、醚和溴等副产物生成,反应结束后将反应混合物蒸馏,分离得到1-溴丁烷。已知有机物具有如下性质:
| |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
| 正丁醇 |
-89.53 |
117.25 |
0.81 |
| 1-溴丁烷 |
-112.4 |
101.6 |
1.28 |
| 丁醚 |
95.3 |
142 |
0.76 |
| 1-丁烯 |
-185.3 |
-6.5 |
0.59 |
试完成下列问题:
(1)生成1溴丁烷的反应的化学方程式是______________________________________。
(2)反应中由于副反应而生成副产物的反应类型是______________________________。
(3)反应加热的温度应__________100 ℃(填“大于”“小于”或“等于”)
(4)反应结束时,从反应混合物中蒸馏得到1-溴丁烷时,应控制的温度范围是____________;选用的装置应是图中的__________ (填序号)。
(5)蒸馏得到的馏分中可能含有的杂质主要是__________,将其进一步除去的方法是________________________________________。
氯气可与潮湿的消石灰反应制取少量漂白粉,也可在浓溶液条件下与石灰石反应生成较浓的HClO溶液。
Ⅰ.甲研究性学习小组利用氯气制少量漂白粉(如图所示):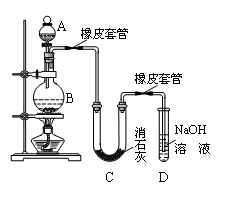
(1)A仪器的名称是,所盛试剂是。
(2)此实验结果所得Ca(ClO)2产率太低。经分析并查阅资料发现主要原因是在U型管中存在两个副反应:
①温度较高时氯气与消石灰反应生成了Ca(ClO3)2,为避免此副反应的发生,可采取的措施是。此副反应的化学方程式为:。
②写出另一个副反应的化学方程式。为避免此副反应发生,可在BC之间加多一个装置,请在答题卷的方框中画出该装置,并标明所用的试剂。
Ⅱ. 乙研究性学习小组研究饱和氯水与石灰石的反应:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水(如图所示),充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。 经检测,上述实验中产生的无色气体均为CO2。请回答:
(3)反应后所得的溶液漂白性增强的原因是。
(4)依据上述实验可推知:②的滤液中的溶质除CaCl2、HClO外,还含有。
纯碱、烧碱等是重要的化工原料。
(1)利用下图所示装置可间接证明二氧化碳与烧碱溶液发生了反应:将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是,反应的离子方程式是_______。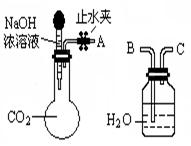
(2)向100 mL2 mol/L的NaOH 溶液中通入一定量CO2,充分反应后将溶液在一定条件下蒸发结晶,得到少量的白色固体。试设计实验确认该白色固体的成分。
①提出合理假设。
假设1:该白色固体为NaOH和Na2CO3;
假设2:该白色固体为只有Na2CO3;
假设3:该白色固体为只有NaHCO3;
假设4:该白色固体为Na2CO3和NaHCO3
②基于假设4,设计实验方案进行实验证明固体的成分是Na2CO3和NaHCO3。请在答题卡上写出实验步骤及预期现象和结论。(步骤可不填满也可增加)
限选实验试剂及仪器: 1moL·L–1HCl溶液、1mol·L–1 MgCl2溶液、0.5mol·L–1BaCl2溶液、1mol·L–1 Ba(OH)2溶液、甲基橙试液、酚酞试液、试管、胶头滴管、过滤装置。
| 实验步骤 |
预期现象和结论 |
| 步骤1: |
|
| 步骤2: |
(14分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:

现称取研细的黄铜矿样品1.150 g,在空气存在下进行煅烧,生成Cu、Fe2O3、FeO和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05000 mol·L-1标准碘溶液进行滴定,初读数为0.10 mL,末读数如右图所示。
(1)冶炼铜的反应为8CuFeS2+ 21O2 高温8Cu + 4FeO + 2Fe2O3+ 16SO2,若CuFeS2中Fe的化合价为+2,反应中被还原的元素是(填元素符号)。
(2)装置a的作用是。
| A.有利于空气中氧气充分反应 | B.除去空气中的水蒸气 |
| C.有利于气体混合 | D.有利于观察空气流速 |
(3)上述反应结束后,仍需通一段时间的空气,其目的是。
(4)滴定时,标准碘溶液所耗体积为mL。用化学方程式表示滴定的原理:。
(5)通过计算可知,该黄铜矿的纯度为。
某课外学习小组为探究硫酸亚铁晶体(FeSO4·7H2O)制备及影响因素,进行如下实验。
Ⅰ制取硫酸亚铁溶液
称取一定量铁屑,放入烧瓶中,加入25 mL 3 mol·L-1硫酸,用酒精灯加热。
(1)加热一段时间后,发现烧瓶中溶液变黄并产生能使品红溶液褪色的气体。产生该现象的原因是
(用化学方程式表示)。
(2)制备过程中,铁需过量的原因是。
Ⅱ实验改进
该小组同学发现以上实验不完善,查阅资料后,对实验做如下
改进:①反应前通入氮气;②水浴加热,控制温度50~60℃;
③实验中适当补充硫酸调节pH=2;④增加尾气吸收装置。改进装置如图(夹持和加热装置略去)。
(3)实验中采用水浴加热,除了便于控制温度外,还有的优点是。
(4)调节pH=2目的是。
(5)下列装置适合尾气吸收的是(填序号)。
Ⅲ 晶体纯度测定
(6)烧瓶中的溶液经处理得硫酸亚铁晶体。准确称取晶体 0.5000 g置于锥形瓶中,加入10 mL 3mol·L-1硫酸溶液和15 mL新煮沸过的蒸馏水进行溶解,立即用0.02000mol·L-1高锰酸钾标准溶液滴定,消耗标准溶液体积的平均值为16.90 mL。(已知:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)
①高锰酸钾标准溶液应盛装在滴定管(填“酸式”或“碱式”)。
②获得硫酸亚铁晶体的纯度为。
氢化钙固体是登山运动员野外常用的能源提供剂。某化学兴趣小组拟选用如下装置制备氢化钙。已知:氢化钙在一定条件下与氧气反应生成的产物不只一种。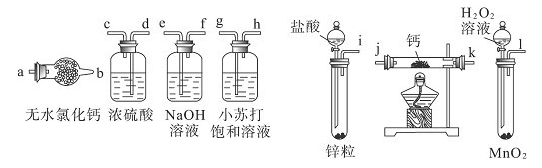
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为______________(填仪器接口的字母编号)。
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗
活塞;______________(请按正确的顺序填入下列步骤的标号)。
| A.加热反应一段时间 | B.收集气体并检验其纯度 |
| C.关闭分液漏斗活塞 | D.停止加热,充分冷却 |
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色。该同学据此判断,上述实验确有CaH2生成。
① 写出CaH2与水反应的化学方程式___________________________;
② 该同学的判断是否准确,原因是______________________________。
(4)请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象_____。
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是____________________。