配制一定溶质物质的量浓度的KOH溶液时,造成实验结果偏低的原因可能是( )
| A.容量瓶中有少量水 |
| B.有少量KOH残留在烧杯中 |
| C.定容时俯视 |
| D.定容时仰视 |
现有四种元素的基态原子的电子排布式如下:① [Ne]3s23p4;②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
| A.最高正化合价:③>②>① | B.原子半径:③>②>① |
| C.电负性:③>②>① | D.第一电离能:③>②>① |
下列图式表示正确的是
A.二氧化碳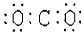 |
| B.次氯酸的结构式 H-Cl-O |
C.铝离子的结构示意图 |
D.基态碳原子的价电子排布图为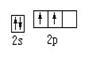 |
价电子排布式为5s25 p3的元素是
| A.第五周期第ⅢA族 | B.51号元素 |
| C.SP区的主族元素 | D.Te |
下列叙述中,正确的是
| A.1s电子云界面图是一个球面,电子云中的每个小黑点代表一个电子 |
| B.NaH中的σ键是由两个原子的s、p轨道以“头碰头”方式重叠形成的 |
| C.对于组成结构相似的分子,一定是相对分子质量越大,熔、沸点越高 |
| D.在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析 |
某溶液中含有1.2×10-3 mol XO3-,恰好能氧化30mL 0.1mol/LNa2SO3溶液(形成Na2SO4溶液),则还原产物中元素X的化合价是
| A.0 | B.- 2 | C.+3 | D.+2 |