实验室配制500 mL 0.5 mol·L-1的稀硫酸溶液,有如下操作步骤:①把量取好的浓硫酸放入小烧杯中,加适量蒸馏水溶解;②把①所得溶液立即小心地转入500 mL容量瓶中;③继续向容量瓶中加蒸馏水至液面距离刻度1—2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切;④用少量蒸馏水洗涤烧杯和玻璃棒2—3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞紧,充分摇匀。
请填写下列空白:
(1)应该量取____________________mL 18.4 mol·L-1浓硫酸。
(2)上述步骤中第___________步不恰当,正确的操作是:___________________________。
(3)实验操作步骤的正确顺序为(填序号):_______________________________。
(4)本实验用到的玻璃仪器有:__________________________________________。
(5)若出现如下情况,对所配溶液浓度将有何影响?没有进行操作④:________________。加蒸馏水时不慎超过了刻度:____________________。定容时俯视读数:______________。
(6)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度:______________。向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面:__________________。
某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题: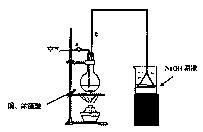
(1)烧杯中用NaOH溶液吸收的物质是:(填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是:。
(2)加热烧瓶20分钟,烧瓶中发生反应的化学方程式是:。
待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的(填仪器序号“a”或“b”)起到了确保硫酸体积保持不变的作用。
(3)将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行____、、后称量硫酸钡的质量为13.98g,请计算能与铜反
应的硫酸的最低浓度是。
(4)有的同学提出在上面(4)中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因:,
。
在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~10nm之间).下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题.
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接,接,接h;
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是,试写出制纳米级碳酸钙的离子方程式;
(3)在浓CaCl2溶液和NH3用量正确的情况下,CO2不足或过量都会导致纳米级碳酸钙产量下降,若CO2过量溶液中大量存在的离子有(不考虑弱电解质的电离和盐类水解产生的少量离子)_____________________________,
(4)取反应后去除CaCO3的溶液分别做以下实验,下列实验判断合理的是:_________.
| A.滴加少量Na2CO3溶液,若有沉淀说明CO2一定不足. |
| B.滴加少量盐酸,若有气泡,CO2一定过量. |
| C.测量溶液pH,若小于7,CO2一定过量 |
| D.滴加少量BaCl2溶液,若无沉淀,CO2一定没有过量. |
(5)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级.
某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、AlO2-、SO42-、SiO32-、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成.
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失.
(1)原溶液中肯定存在的离子是________________,肯定不存在的离子是____________
(2)已知一定量的原溶液中加入5 mL 0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187 g,则原溶液中是否含有Cl-?_________________.
(3)按照反应顺序逐步书写出②中发生反应的离子反应方程式①H++OH-=H2O
②
③
④HCO3-+H+=H2O+CO2
⑤
某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-。为了鉴别这些离子,分别取少量溶液进行以下实验:
①所得溶液呈碱性;
②加HCl后,生成无色无味的气体。该气体能使饱和石灰水变浑浊。
③加CCl4,滴加少量氯水,振荡后,CCl4层未变色。
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量的盐酸,沉淀不能完全溶解。
⑤加HNO3酸化后,再加过量的AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验 ,写出每一实验鉴定离子的结论与理由。
,写出每一实验鉴定离子的结论与理由。
实验①________________________________________。
实验②_______________________________________。
实验③____ ____________________________________。
____________________________________。
实验④________________________________________。
实验⑤________________________________________。
(2)上述5个实验不能确定是否的离子是___________________。
实验室用氯化钠固体配制1 的NaCl溶液0.5L,回答下列问题:
的NaCl溶液0.5L,回答下列问题:
(1)请写出该实验的实验步骤:
①计算,②,③,④,⑤洗涤,⑥,⑦摇匀。
用托盘天平(指针向上的)称量样品时,若指 针偏向右边,则表示()
针偏向右边,则表示()
| A.左盘重,样品轻 | B.左盘轻,砝码重 |
| C.右盘重,砝码轻 | D.右盘轻,砝码重 |
需要NaClg,实际用托盘天平称量的质量是g。
(2)所需仪器除托盘天平,还需要哪些玻璃仪器才能完成该实验,请写出:、、、。
使用容量瓶前必须进行的操作是。
(3)从该溶液中取出50mL,其中NaCl的物质的量浓度为。