A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
|
①A和E的溶液显碱性,0.1mol·L-1A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl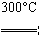 SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1000~1100°C反应制得纯硅。
已知SiHCl3能与H2O剧烈反应,在空气中易自燃。
请回答下列问题:
(1)第①制备粗硅的化学方程式为__________________________ ____________________________________________________________________________________________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0°C)中含有少量SiCl4(沸点57.6°C)和HCl(沸点84.7°C),提纯SiHCl3的方法为__________________________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如图所示(热源及夹持装置均已略去):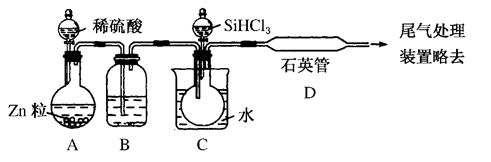
①装置B中的试剂是________,装置C中的烧瓶需要加热,其目的是__________________。
②装置D中发生反应的化学方程式为__________________________________________________________________________________________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及______________________________。
世界著名的科技史专家、英国剑桥大学的李约瑟博士考证说:“中国至少在距今3000年以前,就已经使用玻璃了。”下列有关普通玻璃的说法不正确的是( )
| A.制普通玻璃的原料主要是纯碱、石灰石和石英 |
| B.玻璃在加热熔化时有固定的熔点 |
| C.普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅 |
| D.盛放烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱跟二氧化硅反应生成硅酸钠而使瓶塞与瓶口粘在一起 |
为确定HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。请据此回答: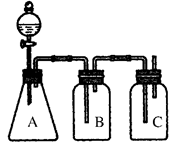
(1)锥形瓶A中装某可溶性正盐溶液,分液漏斗所盛试剂为___________________________。
(2)装置B所盛试剂是____________________,其作用是____________________________。
(3)装置C所盛试剂是________,C中反应的离子方程式是__________________________。
(4)由此可得出的结论是:酸性________>________>________。
为了讲授“氯气的性质和用途”,李老师以二氧化锰和浓盐酸为主要原料制取氯气,并设计了如图所示装置(其中A是连有注射器针头的橡皮管,针头已插入并穿过橡皮塞)进行了教学.
试回答下列问题:
(1)乙中的现象是____________________,丙中的现象是______________,丁中的现象是______________,分离丁中液体的方法是____________;
(2)橡皮管连通后,分液漏斗的气体压强p1与烧瓶中的气体压强p2的关系为________(填“>”“<”或“=”),连接橡皮管的目的是___________________________________________;
(3)烧瓶内发生反应的离子方程式为___________________________________________
________________________________________________________________________.
用滴管把新制的氯水逐滴加到含有酚酞的氢氧化钠溶液中,当加到最后一滴时,溶液的红色突然消失.对产生实验现象的原因有两种推测:①是氯水中的次氯酸的漂白性使它由红色变成无色;②是氯水的酸性(H+)使它由红色变成无色.假设其中一种是正确的.
请你设计一个实验,由实验现象对以上的推测作出判断.
(1)要使用的实验用品:____________________________________________________
________________________________________________________________________;
(2)要进行的实验操作:___________________________________________________
________________________________________________________________________;
(3)实验现象和结论:_____________________________________________________
________________________________________________________________________.