下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。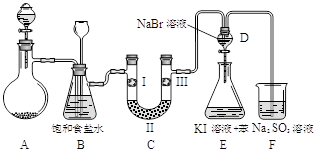
⑴制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:
__________________________________________________________________。
⑵装置B中饱和食盐水的作用是_______________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象______________________________。
⑶装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入_______。
| |
a |
b |
c |
d |
| I |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| II |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| III |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
⑷设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为______色,说明氯的非金属性大于溴。
⑸打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是_____________。
⑹有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:
______________________,判断改用NaHSO3溶液是否可行______(填“是”或“否”)。
某学生课外活动小组利用右图所示装置分别做如下实验:
 (1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是 溶液;加热时溶液由红色逐渐变浅的原因是 。
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是 溶液;加热时溶液由红色逐渐变浅的原因是 。 (2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是 溶液;加热时溶液由无色变为红色的原因是 。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是 溶液;加热时溶液由无色变为红色的原因是 。
某无色溶液中只可能含有①Na+ 、②Ba2 +、③Cl-、④Br-、⑤SO32-、⑥SO42-离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
| 步骤 |
操作 |
现象 |
| (1) |
用pH试纸检验 |
溶液的pH大于7 |
| (2) |
向溶液中滴加氯水,再加入CCl4振荡,静置 |
CCl4层呈橙色 |
| (3) |
向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
| (4) |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是()
| A.肯定含有的离子是①④⑤ | B.肯定没有的离子是②⑤ |
C.可能含有的离子是①⑥ | D.不能确定的离子是③⑥ |
对某酸性溶液(可能含有Br-,SO42-,H2SO3,NH 4+)分别进行如下实验: ①加热时放出的气体可以使品红溶液褪色;
①加热时放出的气体可以使品红溶液褪色; ②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝;
②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝; ③加入氯水时,溶液略显黄色,再加入溶液,产生的白色沉淀不溶于稀硝酸。
③加入氯水时,溶液略显黄色,再加入溶液,产生的白色沉淀不溶于稀硝酸。 对于下列物质不能确认其在原溶液中是否存在的是()
对于下列物质不能确认其在原溶液中是否存在的是()
A. |
B. |
C. |
D. |
检验二氧化硫气体中有无二氧化碳气体,应采取的方法是()
| A.通过澄清石灰水 | B.先通过足量小苏打溶液,再通过石灰水 |
C.先通过足量酸性高锰酸钾溶液,再通过澄清石灰水 | D.通过品红溶液 |
中学教材高中化学第一册有如下图1所示的铜与浓硫酸反应实验装置,该实验过程中会有二氧化硫气体放出,污染室内空气,严重地损害师生健康.为此某课外小组对此实验进行如图2所示的改进,改进的实验操作简单现象明显,并且几乎无二氧化硫气体泄漏。实验步骤如下:


 图1图2
图1图2 ①首先按装置图安装仪器,安装仪器时,在支管胶塞的铁丝构上挂一片品红试纸。
①首先按装置图安装仪器,安装仪器时,在支管胶塞的铁丝构上挂一片品红试纸。 ②向试管中加入约10毫升的浓硫酸,加热(在加热浓硫酸时,将铜片向上提起,铜片先不要伸入浓硫酸中),当加热至沸腾时,把铜片放下,使其完全浸入浓硫酸中,反应即刻发生。等不需要反应时停止加热并将铜片提起,离开浓硫酸,反应就停止了。
②向试管中加入约10毫升的浓硫酸,加热(在加热浓硫酸时,将铜片向上提起,铜片先不要伸入浓硫酸中),当加热至沸腾时,把铜片放下,使其完全浸入浓硫酸中,反应即刻发生。等不需要反应时停止加热并将铜片提起,离开浓硫酸,反应就停止了。 回答下列问题:
回答下列问题: (1)如图2所示,铜片与沸腾的浓硫酸接触后可看到的现象有: ;
(1)如图2所示,铜片与沸腾的浓硫酸接触后可看到的现象有: ; (2)塑料袋作用是: ;
(2)塑料袋作用是: ; (3)为了防止反应结束后留在试管中的气体和塑料袋中的气体污染环境,可进行的操作是:;相关的离子方程式是:。
(3)为了防止反应结束后留在试管中的气体和塑料袋中的气体污染环境,可进行的操作是:;相关的离子方程式是:。