为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:
(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃,甲同学因此认为SO2与Na2O2的反应不同于CO2。请按甲同学的观点写出反应的化学方程式 。
(2)乙同学认为无论反应原理如何,最终都有O2产生,乙同学的理由是 。按照乙同学的观点,该装置需做的改进是
。
(3)假设Na2O2完全反应,反应后B装置中固体生成物可能是:①Na2SO3;②Na2SO4;③Na2SO3和Na2SO4。
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成下表:
限选试剂:2 mol·L-1 HCl溶液,1 mol·L-1 HNO3溶液,1 mol·L-1 BaCl溶液,1 mol·L-1 Ba(NO3)2溶液,0.01 mol·L-1 KMnO4酸性溶液。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中 |
固体完全溶解 |
| 步骤2:往Ⅰ试管中加入 ,再滴加 |
, |
| 则证明生成物中含Na2SO4 |
|
| 步骤3:往Ⅱ试管中 |
|
| |
若 , |
| 则证明生成物中有Na2SO3;若 |
|
| |
|
| 则说明生成物中没有Na2SO3。 |
|
(4)生成物中亚硫酸钠含量的测定:
①取a g生成物配制成100 mL溶液,取10.00 mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,用0.010 0 mol·L-1碘水进行滴定,滴定终点现象为 。记录数据,重复滴定2次,平均消耗碘水20.00 mL。
②计算:生成物中亚硫酸钠的质量分数为 。
(2014届福建省莆田市高三3月质量检测化学试卷)
氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有趾Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。(已知:AlN+NaOH+H2O=NaAlO2+NH3↑)
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
(1)上图C装置中球形干燥管的作用是______________。
(2)完成以下实验步骤:组装好实验装置,首先____________,再加入实验药品。接下来的实验操作是______________,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是______________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见___________。
【方案2】用右图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。
(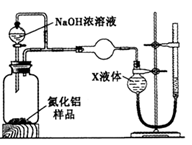
(4)为测定生成气体的体积,量气装置中的X液体可以是_________________________。
a.CCl4 b.H2O c.NH4Cl溶液 d.
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则AIN的质量分数__。
【方案3】按以下步骤测定样品中A1N的纯度:
(6)步骤②生成沉淀的离子方程式为___________________。
(7)若在步骤③中未洗涤,测定结果将__________(填“偏高”、“偏低”或“无影响”)。
(2014届甘肃河西五市部分普通高中高三第一次联合考试化学试卷)
图中是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。
(1)在组装好装置后,若要检验A~E装置的气密性,其操作是首先___ _____,在E中装入水,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成,说明装置气密性良好。
(2)装置B中盛放的试剂是________。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍候片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生________(答现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式:________________________。
(4)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中,写出产生白烟的化学方程式:____________________,迅速产生倒吸的原因是____________________________。
(2014届江苏省如东县高三上学期期末四校联考化学试卷)
草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的制取和草酸的性质,进行如下实验。
实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如下图所示
①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸(65%的HNO3与98%的H2SO4的质量比2︰1.25)
③反应3小时,冷却,抽滤后再重结晶得到草酸晶体
硝酸氧化淀粉水解液的反应为:
C6H12O6+12HNO3 3H2C2O4+9NO2↑+3NO↑+9H2O
3H2C2O4+9NO2↑+3NO↑+9H2O
(1)上图实验装置中仪器乙的名称为:________________________。装置B的作用是。
(2)检验淀粉是否水解完全的方法:______________________________________________。实验Ⅱ:探究草酸与酸性高锰酸钾的反应
(3)向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,写出上述反应的离子方程式:____________________________________________________。
(4)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快。为探究其原因,同学们做了如下对比实验;
由此你认为溶液褪色总是先慢后快的原因是_________________________________________。
(5)草酸亚铁在工业中有重要作用,草酸可以制备草酸亚铁,步骤如下:
称取FeSO4·7H2O固体于小烧杯中,加入水和少量稀H2SO4溶液酸化,加热溶解。向此溶液中加入一定量的H2C2O4溶液,将混合溶液加热至沸,不断搅拌,以免暴沸,待有黄色沉淀析出并沉淀后,静置。倾出上清液,再加入少量水,并加热,过滤,充分洗涤沉淀,过滤,用丙酮洗涤固体两次并晾干。
①生成的草酸亚铁需充分洗涤沉淀,检验是否洗涤完全的方法是 。
②用丙酮洗涤固体两次的目的是 。
(届福建省厦门市高三质量检查(第一次)理综化学试卷)
亚硝酸钠(NaNO2)是一种外观与食盐相似的食品添加剂。某化学兴趣小组进行如下实验。
【实验I】
用如下装置(已省略夹持装置)制NaNO2。
已知:2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
(1)仪器甲的名称是________.装置B的作用是_________________________。
(2)装置D可将剩余的NO氧化成NO ,发生反应的离子方程式为_____________。
,发生反应的离子方程式为_____________。
(3)使用气密性良好的上述装置进行实验,NaNO2的纯度较低。为提高NaNO2纯度须对
上述实验装置或药品进行改进,其改进措施是________________________________。
【实验Ⅱ】
利用目视比色法(比较溶液颜色深浅以测定物质浓度)测定泡菜样品中NaNO2的含量。
步骤i:在5个有编号的试管中分别加入不同量的NaNO2溶液,各加入1 mL的M溶液 (M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为l0 mL并振荡,制成标准色阶。

步骤ⅲ:取5 mL待测液X,加入1 mLM溶液,加蒸馏水至10mL振荡,与标准色阶比较。
(4)步骤ii获取待测液X的过程中,加入明矾的目的是__________。
(5)步骤iii比较结果与④号色阶颜色相同,此泡菜样品中NaNO2的含量为_________mg·kg-1
(6)用目视比色法证明泡菜中加入维生素C可以降低NaNO2的含量。设计并完成下列实
验报告。
(2014届福建省漳州市高三3月质检理综化学试卷)
某研究性学习小组欲探究Na2CO3溶液与MgCl2溶液反应产生白色沉淀的成分,小组成员做如下实验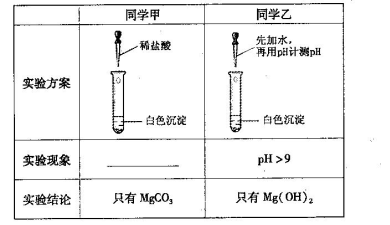
(1)若按所得的结论分析,甲观察到的实验现象是___________________________。
(2)在探究沉淀物成分前,甲、乙都将沉淀物从溶液中分离出来,洗涤并干燥。同学丙认为他们并未将沉淀洗涤干净,请用简单的实验证明丙的观点。
(3)同学丁认为甲结论不合理,理由是Ksp(MgCO3)___Ksp [Mg(OH)2](选填“<”或“>”),所以沉淀物未必是MgCO3。经查阅资料得知:该白色沉淀的组成应为Mgx(OH)y(CO3)z·nH2O。为确定沉
淀物的具体组成,他设计下图装置进行实验(所有夹持装置已省略)。
(4)请将丁设计的实验步骤补充完整:
①检查装置气密性;
②先装入药品,并称量相关装置的质量,后连接各装置;
③________________________________________________________;
④停止加热,持续通入空气直至实验结束,再次称量步骤②中相关装置的质量。
(5)装置E中碱石灰的作用是_________________________________________________。
三次实验所得数据如下:(部分数据已换算为相应的物质的量)
(6)分析实验数据可知,第_________组出现误差较大的数据,应舍去。由实验数据计算
得该白色沉淀物的组成为___________(选填序号)。
a.Mg2(OH)2CO3·3H2O b.Mg(OH)2(CO3)2·3H2O
c.Mg4(OH)2(CO3)3·3H2O d.Mg5(OH)4(CO3)3·2H2O