AB2离子化合物的阴、阳离子的电子层结构相同,1molAB2分子中含有54mol电子,且有下列反应:
①H2+B2 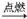 C
C
②B2+X→Y+AB2+H2O
③Y+C→AB2+Z,已知Z有漂白作用
(1)写出下列物质的化学式:
AB 2,X ,
Y ,Z 。
(2)写出反应②的化学方程式 。
(3)写出反应③的离子方程式 。
现有室温下浓度均为1×10-3 mol·L-1的几种溶液:①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH溶液。回答下列问题:
(1)上述6种溶液中,水电离出的c(H+)最大的是________,最小的是________。
(2)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③____________⑥(填“>”“<”或“=”),溶液中的离子浓度由大到小的顺序为______________。
(3)将等体积的①、⑤混合,则溶液的pH________7(填“>”“<”或“=”),用离子方程式说明其原因: _________________________________。
(4)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为________________,最终产生H2总量的关系为________。
(5)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH大小关系为①________③(填“>”“<”或“=”,下同)。
(6)若将等体积的⑤、⑥溶液加热至相同温度后,溶液的pH大小关系为⑤________⑥。
将0.2 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-),则:
(1)混合溶液中c(A-)________c(HA)(填“>”“<”或“=”,下同)。
(2)混合溶液中c(HA)+c(A-)________0.1 mol·L-1。
(3)混合溶液中,由水电离出的c(OH-)________0.2 mol·L-1 HA溶液中由水电离出的c(H+)。
(4)25 ℃时,如果取0.2 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合溶液的pH<7,则HA的电离程度________NaA的水解程度。
在标准状况下充满HCl的烧瓶做完喷泉实验后得到稀盐酸,用标准碳酸钠溶液滴定这种盐酸测定它的准确浓度,请你回答下列问题:
(1)用标准Na2CO3溶液滴定这种盐酸时,Na2CO3溶液应装在___________式滴定管中,若用甲基橙作指示剂,达到滴定终点时,溶液从___________色变为___________色。
(2)现配制三种浓度的标准Na2CO3溶液,你认为最合适的是下列第___________种(填序号)。
①2.500 mol·L-1 ②0.25 mol·L-1 ③0.025 mol·L-1
(3)若采用上述合适浓度的标准Na2CO3溶液滴定,用c(Na2CO3)表示,滴定时实验数据列表如下:
| 实验编号 |
待测盐酸体积(mL) |
滴入Na2CO3溶液体积(mL) |
| 1 |
20.00 |
18.80 |
| 2 |
20.00 |
16.95 |
| 3 |
20.00 |
17.05 |
求这种待测稀盐酸的物质的量浓度(用数据和符号列式即可):c(HCl)=________。
(4)用A.偏高;B.偏低;C.无影响;D.无法判断,填写下列各项操作会给实验造成的误差。
①开始滴定时,滴定管尖端处有气泡,滴定完毕气泡排出( )
②滴定前读数时仰视,滴定完毕读数时俯视( )
(1)不同温度下水的离子积的数据:KW(25 ℃)=1×10-14;Kt1=a;Kt2=1×10-12,试回答以下问题:
①若25<t1<t2,则a________1×10-14(填“>”“<”或“=”),做此判断的理由是_______________________。
②25 ℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=____________。
③在t2温度下测得某溶液pH=7,该溶液显__________(填“酸”“碱”或“中”)性。
(2)在一定温度下,有以下三种酸:
a.醋酸 b.硫酸 c.盐酸
①当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是______________(用a、b、c表示,下同)。
②当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为____________。反应所需时间的长短关系是____________。
③将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是____________。
汽车尾气是造成大气污染的主要原因之一,在汽车排气管上安装“催化转换器”使汽车的尾气转换成无毒气体是目前最有效的手段之一。如果用●表示碳原子,用○表示氧原子,用表示氮原子,如图为气体转换的微观过程。请你根据图示回答下列问题:
(1)A、B、C三种物质可以归为一类的依据是________________。
(2)将C归为化合物,将D归为单质的理由是________________。
(3)用化学反应方程式表示为____________________。化学变化过程中消耗的A物质和生成的C物质的质量比为________________。