(8分)某种橡胶分解产物为碳氢化合物,对这种碳氢化合物进行以下实验:
①若取一定量的橡胶完全燃烧,燃烧后的气体通过干燥管,干燥管增重0.72 g,再通过足量的石灰水,石灰水增重2.2 g。
②经测定,该碳氢化合物(气体)的密度是相同状况下氢气密度的34倍。
③该碳氢化合物0.10 mol能和32 g溴起加成反应,经分析,产物中溴原子分布在不同的碳原子上,且溴代物中有1个碳原子在支链上,试推断:
(1)该碳氢化合物的结构简式是____________,名称是___________。
(2)该橡胶的结构简式是______________________,名称是______________________。
(1)同温同压下,同体积的NH3和H2S气体的质量比是___________;同质量的NH3和H2S气体的体积比是__________;同质量的NH3和H2S气体中所含氢原子个数比是___________;若两者所含氢原子个数相等,它们的物质的量比是________。
(2)Na2SO4••10H2O的摩尔质量是__________,483gNa2SO4••10H2O中所含Na2SO4••10H2O的物质的量是_______,所含Na+的物质的量是_________,所含H2O分子的数目是_______个。
在有机物分子中,不同位置的氢原子的核磁共振谱中给出的特征峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。
(1)下列有机物分子中,其核磁共振氢谱图中只有1个峰的物质是________。
| A.CH3—CH3 | B.CH3COOH | C.CH3COOCH3 | D.CH3COCH3 |
(2)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如下所示,则A的结构简式为________。请预测B的核磁共振氢谱图上有________个峰。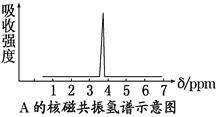
写出下列反应的化学方程式
(1) 苯的硝化反应
(2) 实验室制取乙烯
(3)乙烯与溴水反应
(4)乙烯发生加聚反应
用系统命法写出下列物质名称或结构简式
(1)2,2,3-三甲基丁烷的结构简式是
(2)1,3-丁二烯的结构简式是
(3) 的系统命名是:
的系统命名是:
(4) 的系统命名是
的系统命名是
下列各组物质:① O2和O3;②12C和14C;③ CH3CH2CH2CH3和(CH3)2CHCH3;④乙烷和丁烷;⑤ CH3CH2CH2CH(C2H5)CH3和 CH3CH2CH2CH(CH3)C2H5。
互为同系物的是,互为同分异构体的是,互为同位素的是,互为同素异形体的是,是同一物质的是。