在水溶液中,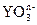 和S2-发生反应的离子方程式如下:
和S2-发生反应的离子方程式如下:
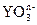 +3S2-+6H+
+3S2-+6H+  Y-+3S↓+3H2O
Y-+3S↓+3H2O
(1)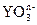 中Y元素的化合价是 。
中Y元素的化合价是 。
(2)Y元素原子的最外层电子数是 。
(3)比较S2-和Y-的还原性 。
置换反应可用下图表示,回答下列问题:
(1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则该反应的离子方程式为。
(2)若过量单质甲与化合物A发生反应现象为溶液由蓝色变为浅绿色, 除去反应后混合物中剩余的甲所用的试剂名称是写出单质甲与化合物A反就的离子方程式。
(3)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式
(4)若单质乙是红色金属固体单质,化合物B常温下为无色液体,则该反应的化学方程式为。
A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,K、L是无色气体,且K是非极性分子,F、H是黑色晶体。以上物质相互间的转化关系如下图所示:
请回答下列问题:
(1)元素A的核外电子排布式为________________。
(2)D能与氢氧化钠溶液反应,请写出该反应的离子方程式___________________。
(3)写出A与G反应的化学方程式_______________________________________。
(4)写出H和D反应的化学方程式______________________________________。
(5)写出K与E反应的化学方程式_________________________________________。
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
(1)④、⑤、⑥的原子半径由大到小的顺序为________________。(用元素符号表示)
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是________。(用化学式表示)
(3)某化合物由①、④、⑧三种元素组成,它有强氧化性,是很好的漂白剂、杀菌剂,请写出它的化学式:____________________。
(4)Ⅰ.下列可作为比较② 和③ 非金属性强弱的依据是(填序号)。
a.自然界中的含量 b.氢化物的稳定性
c.最高氧化物水化物溶液的酸性 d.单质与酸反应时失去的电子数
Ⅱ.从原子结构的角度解释③ 的非金属性强于②的原因:电子层数相同,核电荷数③ 大于② ,原子半径③②,所以原子核对最外层电子的吸引力③②,得电子能力③大于② 。
(5)⑥的氧化物与③的最高氧化物水化物溶液反应的离子方程式 。
A、B、C、 D、 E五种溶液分别是NaOH、NH3·H2O、CH3COOH 、HCl、NH4HSO4中的一种。常温下进行下列实验:
①将1 L pH=3的A溶液分别与0.001mol·L-1 xL B溶液、0.001mol·L-1 yL D溶液充分反应至中性,x、y大小关系为: y<x;
②浓度均为0.1mol·L-1A和E溶液,pH:A<E;
③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是 溶液,判断理由是 。
(2)用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是 (填写序号)
① ②
② ③ c(H+)和c(OH-)的乘积④ OH-的物质的量
③ c(H+)和c(OH-)的乘积④ OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)
①反应所需要的时间E>A
②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E
④反应过程的平均速率 E>A
⑤A溶液里有锌粉剩余
⑥E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中的_________曲线(填写序号) 。室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为 。
中学常见化学反应方程式为:A+B→X+Y+H2O(未配平,反应条件略去),其中,A、B的物质的量之比为1:4。请回答:
(1)若Y为黄绿色气体,该反应的离子方程式为,B体现出的化学性质有
(2)若A为常见的非金属单质,B的溶液为某浓酸,反应条件为加热,其反应的化学方程式为
(3)若A为某不活泼的金属单质,实验室常用该反应来制备某种能形成酸雨的气体,该反应中氧化剂与还原剂的物质的量之比为
(4)若A为常见的金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①A元素在元素周期表中的位置是
②含amolX的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X的物质的量是