(6分)有一瓶澄清的溶液,其中可能含有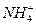 、K+、Na+、Mg2+、Ba2+、Al3+、Fe2+、
、K+、Na+、Mg2+、Ba2+、Al3+、Fe2+、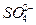 、
、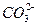 、
、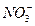 、Cl-、Al O2-、I-,取该溶液进行如下实验:
、Cl-、Al O2-、I-,取该溶液进行如下实验:
(1)用pH试纸实验,表明溶液呈强碱性,焰色反应透过蓝色钴玻璃观察到紫色火焰。
(2)取部分溶液,加入少量CCl4及数滴新制的氯水,经摇荡后,CCl4层呈紫红色。
(3)另取部分溶液,逐滴加入稀HCl溶液,使溶液从碱性逐渐变为酸性,在滴加过程中溶液出现沉淀。滴加完毕后,溶液中沉淀消失。
(4)取部分上述酸性溶液,加BaCl2溶液,有白色沉淀生成。
(5)往(3)得到的酸性溶液通H2S气体,溶液中有浅黄色沉淀产生。
根据上述实验事实确定并完成下列问题:
在溶液中肯定存在哪些离子_________________________________________,
肯定不存在哪些离子_______________________________________________,
还不能确定存在哪些离子___________________________________________。
实验室以含有
、
、
、
、
等离子的卤水为主要原料制备无水
和
,流程如下:
(1)操作Ⅰ使用的试剂是,所用主要仪器的名称是。
(2)加入溶液W的目的是。用
调节溶液Y的
,可以除去
。由表中数据可知,理论上可选择
最大范围是。酸化溶液Z时,使用的试剂为。
(3)实验室用贝壳与稀盐酸反应制备并收集
气体,下列装置中合理的是。
| A. |
a. |
| B. |
b. |
| C. |
c. |
| D. |
d. |
(4)常温下,
的电离常数
,
,
的电 离常数
,
。某同学设计实验验证
酸性强于
:将
和
气体分别通入水中至饱和,立即用酸度计测两溶液的
,若前者的
小于后者,则
酸性强于
。该实验设计不正确,错误在于。
离常数
,
。某同学设计实验验证
酸性强于
:将
和
气体分别通入水中至饱和,立即用酸度计测两溶液的
,若前者的
小于后者,则
酸性强于
。该实验设计不正确,错误在于。
设计合理实验验证
酸性强于
(简要说明实验步骤、现象和结论)。。仪器器自选。
供选的试剂:
、
、
、
、
、
、蒸馏水、饱和石灰水、酸性
溶液、品红溶液、
试纸。
二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分装置省略)如下:
在反应装置中,加入原料及溶剂,搅拌下加热回流。反应结束后加水煮沸,冷却后即有二苯基乙二酮精产品析出,用70%乙醇水溶液重结晶提纯。重结晶过程。
加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
请回答以下问题:
(1)写出装置图中下班仪器的名称:a.b
(2)趁势过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体:
A.缓慢冷却溶液 B.溶液深度较高
C.溶质溶解度较小 D.缓慢蒸发溶剂
如果溶液发生过饱和现象,可采用.等方法促进晶体析出。
(3)抽滤所用的滤纸应略(填"大于"或"小于")布氏漏斗内径,将全部小孔盖住。烧杯中的二苯基乙二酮品体转人布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是
A.无水乙醇 B.饱和氯化钠溶液
C.70%乙醇水溶液 D.滤液
(4)上述重结晶过程中的哪一步操作除去了不溶性杂质:。
(5)某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始,回流15
、30
、45
和60
时,用毛细管取样、点样,薄层色谱展开后的斑点如下图所示。该实验条件下比较合适的回流时间是。
A. 15
B.30
C. 45
D.60

某研究小组在实验室探究氨基甲酸铵(
)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:

实验测得不同温度下的平衡数据列于下表:
| 温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强/ | 5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度/ | 2.4×10-3 |
3.4×10-3 |
4.8×10-3 |
6.8×10-3 |
9.4×10-3 |
①可以判断该分解反应已经达到平衡的是。
| A. | B. | 密闭容器中总压强不变 | |
| C. | 密闭容器中混合气体的密度不变 | D. | 密闭容器中氨气的体积分数不变 |
②根据表中数据,列式计算25.0℃时的分解平衡常数:
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量是(填"增加","减少"或"不变")。
④氨基甲酸铵分解反应的焓变
O(填">"、"="或"<"),熵变
O
(填">"、"="或"<")。
(2)已知:

该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到
时间的变化趋势如图所示。

⑤计算
时,0-6
氨基甲酸铵水解反应的平抑速率。
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:。
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的.已知:氧化性:
;还原性:
;
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有
、
、
、
),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份.第一份试液中滴加
溶液后显红色;第二份试液中加足量
固体,溶液显淡黄色,用
萃取,下层溶液显紫红色;第三份试液中加入适量
固体后,滴加淀粉试剂,溶液不变色.
①加
溶液显红色,该红色物质是(用化学式表示);
中显紫红色的物质是(用电子式表示).
②第二份试液中加入足量
固体后,反应的离子方程式为、.
(2)
作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失.写出潮湿环境下
与氧气反应的化学方程式:.将
溶于
溶液,在低温条件下,可制得
.该物质作为食盐加碘剂是否合适?(填"是"或"否"),并说明理由.
(3)为了提高加碘盐(添加
)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是.
| A. | B. | C. | D. |
(4)对含 较多的食盐(假设不含 ),可选用 作为加碘剂.请设计实验方案,检验该加碘盐中的 ..
地下水中硝酸盐造成的氮污染已成为一个世界性的环节问题。文献报道某课题组模拟地下水脱氮过程,利用
粉和
溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。
(1)实验前:①先用0.1
洗涤
粉,其目的是,然后用蒸馏水洗涤至中性;②将
溶液的
调至2.5;③为防止空气中的
对脱氮的影响,应向
溶液中通入(写化学式)。
(2)右图表示足量
粉还原上述
溶液过程中,测出的溶液中相关离子浓度、
随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式。t1时刻后,改反应仍在进行,溶液中
的浓度在增大,
的浓度却没有增大,可能的原因是。
(3)改课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三:
假设一:溶液的
;
假设二:;
假设二:;
(4)请你设计实验验证上述假设一,写出实验步骤及结论。(已知:溶液中的
浓度可用离子色谱仪测定)