某主族元素原子的第五电子层只有1个电子,其单质和化合物不可能具有的性质是( )
| A.它的单质仍易被氧化 |
| B.它的化合物熔点较高 |
| C.它同氧气反应的产物只有一种 |
| D.它的碳酸盐溶液有明显的碱性 |
如图为某有机物的结构简式。已知酯类在铜铬氧化物(CuO·CuCrO4)催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢化过程中不变,其反应原理如下:在铜铬氧化物催化下,R1COOR2 + 2H2→R1CH2OH + R2OH
关于该化合物的下列说法中,正确的是()
A.该有机物的化学式为C20H 14O5,该有机物可以属于酯类、酚类、醚类 14O5,该有机物可以属于酯类、酚类、醚类 |
| B.该有机物可以与浓溴水发生加成反应 |
C.1mol该有机物在铜铬氧化物催化下仅能与2mol氢 气发生反应 气发生反应 |
| D.与足量氢氧化钠溶液充分反应,1mol该有机物最多可以与5molNaOH反应,所得产物中有醇类物质 |
科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:下列说法错误的是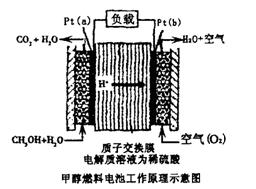
| A.a是负极,b是正极 |
| B.b极的电反应是:O2+4H++4e-=2H2O |
| C.甲醇在a极上得电子,发生还原反应 |
D.当电路上通过2mol电子消耗的CH3OH为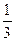 mol mol |
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应是:
A(g)+xB(g) 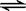 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是

| A.8min前正反应速率大于逆反应速率 |
| B.20min时A的反应速率为0.05mol/(L·min) |
| C.反应方程式中的x=1,正反应为吸热反应 |
| D.30min时降低温度,40min时升高温度 |
已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正 确的是( )
确的是( )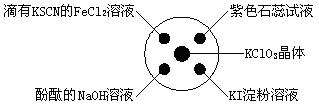
| 选项 |
实验现象 |
结论 |
| A |
滴有KSCN的FeCl2溶液变红色 |
Cl2具有还原性 |
| B |
滴有酚酞的NaOH溶液褪色 |
Cl2具有酸性 |
| C |
石蕊溶液先变为红色后褪色 |
Cl2具有漂白性 |
| D |
KI淀粉溶液中变蓝色 |
Cl2具有氧化性 |
下列叙述中完全正确的一组是()
①常温常压下,1 mol甲基(—CH3)所含的电子数为10NA
②由Cu、Zn和稀硫酸组成的原电池中,若Cu极生成0. 2 g H2,则电路通过电子0.2NA
③在标准状况下,11.2 L NO与11.2 L O2混合后气体分子数为0.75NA
④常温常压下,16 g O3所含的原子数为NA
⑤1 mol C10H22分子中共价键总数为31NA
⑥1 mol Cl2发生反应时,转移的电子数一定是2NA
⑦标准状况下22. 4 L水中含分子数为NA
| A.①②③④⑤ | B.②④⑤⑥⑦ | C.②④⑤ | D.①②⑤ |