有A、B、C、D四种元素。已知:(1)它们均为周期表中前20号元素,C、D在同一周期,A、B在同一主族;(2)它们可以组成化合物B2C2、A2C、DC2等;(3)B的阳离子与C的阴离子的核外电子排布相同;(4)B2C2同A2C或DC2反应都生成C2的气体,B与A2C反应产生气体A2,A2与气体C2按体积2∶1混合后点燃能发生爆炸,其产物是一种无色、无味的液体(在常温下)。请回答下列问题:
(1)写出A、B、C、D四种元素的符号:A__________、B__________、C__________、D__________。
(2)在B2C2、A2C和DC2中,属于离子化合物的是__________,其电子式是__________;属于共价化合物的是__________,其结构式是__________。
[化学——物质结构与性质]
氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节。
Ⅰ 氢气的制取
(1)水是制取氢气的常见原料,下列说法正确的是(填序号)。
A.H3O+的空间构型为三角锥形
B.水的沸点比硫化氢高
C.冰晶体中,1 mol水分子可形成4 mol氢键
(2)科研人员研究出以钛酸锶为电极的光化学电池,用紫外线照射钛酸锶电极,使水分解产生氢气。已知钛酸锶晶胞结构如图,则其化学式为。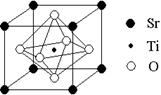
Ⅱ 氢气的存储
(3)Ti(BH4)2是一种储氢材料。
①Ti原子在基态时的核外电子排布式是。
②Ti(BH4)2可由TiCl4和LiBH4反应制得,TiCl4熔点-25.0℃,沸点136.94℃,常温下是无色液体,则TiCl4晶体类型为。
(4)最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子。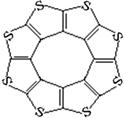
①元素电负性大小关系是:CS(填“>”、“=”或“<”)。
②分子中C原子的杂化轨道类型为。
③有关键长数据如下:
| C—S |
C=S |
C16S8中碳硫键 |
|
| 键长/pm |
181 |
155 |
176 |
从表中数据可以看出,C16S8中碳硫键键长介于C—S与C=S之间,原因可能是:。
④C16S8与H2微粒间的作用力是。
[化学—有机化学基础]
对甲基苯甲酸乙酯(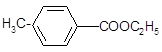 )是用于合成药物的中间体.请根据下列转化关系图回答有关问题:
)是用于合成药物的中间体.请根据下列转化关系图回答有关问题: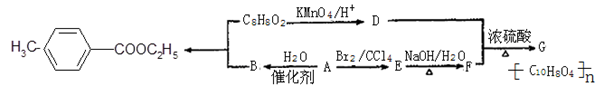 ·
·
(1)D中含有官能团的名称是,A-B的反应类型为。
(2)G的结构简式为。
(3)写出1种属于酯类且苯环上只有一个取代基的C8H8O2的同分异构体。
丁香酚( )是对甲基苯甲酸乙酯的同分异构体,下列物质与其能发生反应的是(填序号)。
)是对甲基苯甲酸乙酯的同分异构体,下列物质与其能发生反应的是(填序号)。
| A.NaOH(aq) | B.NaHCO3(aq) | C.酸性KMnO4(aq) | D.FeCl3(aq) |
(5)写出合成对甲基苯甲酸乙酯的化学方程式。
工业上SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
提示:①已知在酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式.
②已知Ksp[Sn(OH)2] =1.0×10-26
回答下列问题:
(1)SnCl2用盐酸而不用水直接溶解的原因是__________,加入Sn粉的作用是_________。
(2)反应I生成的沉淀为SnO,写出该反应的离子方程式___________________________。
(3)检验沉淀已经“漂洗”干净的方法__________________________________________。
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0mol•L-1,则应控制溶液pH_____。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,请写出发生反应的离子方程式____________。
中学化学常见的物质A、B、C、D之间存在如下转化关系:A + B →C+D + H2O(没
有配平)请按要求填空:
(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体。C、D两种气体均能使澄清石灰水变浑浊,则该反应的化学方程式是:______________________,鉴别这两种气体不能选用的试剂是___________。
a.BaCl2溶液 b.KMnO4溶液 c.品红溶液 d.酸化的Ba(NO3)2溶液
向500mL 2mol•L-1的NaOH溶液中通入0.8mol无色无味的C气体,恰好反应完全,此时反应混合液中物质的量最大的微粒是;此时溶液中的阴离子按照浓度由大到小排列的顺序是______。
(2)若A与适量B的溶液在常温下恰好完全反应,生成的无色气体C遇空气迅速变成红棕色,将生成的红棕色气体通入一个烧瓶里,塞紧瓶塞后,将烧瓶浸入冰水中,烧瓶中气体的颜色变浅,请用化学方程式和必要的文字解释颜色变化的原因_______________________________。
(3)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质,C是漂白粉的有效成分之一,C发生水解反应的离子方程式是______________________________。
【化学一有机化学基础】
苹果中富含对人体有益的苹果酸,可用乙酸和X为原料按如下线路合成: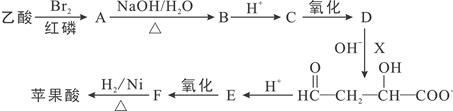
已知: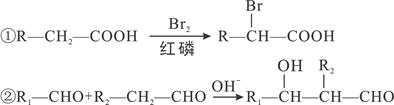
请回答下列问题:
(1)乙酸→A的反应类型。
(2)写出X的结构简式。
(3)F中有种官能团。
(4)有关E的下列说法不正确的是()
| A.能发生银镜反应 | B.1mol E能与2molH2反应 |
| C.能发生消去反应 | D.能与FeCl3溶液发生显色反应 |
(5)A→B反应的化学方程式 。
(6)苹果酸可发生分子内酯化反应,形成的环状酯有(写结构简式)。