中学化学常见的物质A、B、C、D之间存在如下转化关系:A + B →C+D + H2O(没
有配平)请按要求填空:
(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体。C、D两种气体均能使澄清石灰水变浑浊,则该反应的化学方程式是:______________________,鉴别这两种气体不能选用的试剂是___________。
a.BaCl2溶液 b.KMnO4溶液 c.品红溶液 d.酸化的Ba(NO3)2溶液
向500mL 2mol•L-1的NaOH溶液中通入0.8mol无色无味的C气体,恰好反应完全,此时反应混合液中物质的量最大的微粒是 ;此时溶液中的阴离子按照浓度由大到小排列的顺序是______。
(2)若A与适量B的溶液在常温下恰好完全反应,生成的无色气体C遇空气迅速变成红棕色,将生成的红棕色气体通入一个烧瓶里,塞紧瓶塞后,将烧瓶浸入冰水中,烧瓶中气体的颜色变浅,请用化学方程式和必要的文字解释颜色变化的原因_______________________________。
(3)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质,C是漂白粉的有效成分之一,C发生水解反应的离子方程式是______________________________。
硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2。850℃~950℃时,硫铁矿在空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4∶1):
3FeS2 + 8O2 = Fe3O4 + 6SO2①
4FeS2 + 11O2 = 2Fe2O3 + 8SO2②
(1)含硫35%的硫铁矿样品(杂质不含硫),其FeS2的含量为_________________。
(2)设1 t纯净的FeS2按②式完全反应,产生标准状况下SO2__________ m3。
(3)为使FeS2煅烧完全生成Fe2O3,工业上使用过量空气,当空气过量20%时,所得炉气中SO2的体积分数为多少?。
(4)480 g纯净的FeS2在空气中完全反应,若所得固体中,Fe和O
的物质的量之比n(Fe)∶n(O) =4∶a,此时消耗空气为bmol。
①试写出b与a的关系式:___________________。
②并作出b与a的关系曲线。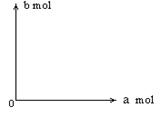
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化关系如图所示(部分产物已略去)。请按要求回答下列问题: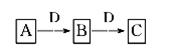
(1)若B、C为氧化物且C对应的水化物为强酸。B转化为C时,质量增加25%,则氢化物A转化为B的化学方程式是。
(2)若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则B生成C的化学方程式是,将B的溶液加热蒸干再灼烧,得到的固体物质的化学式是__________。
(3)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,则A和C反应的离子方程式是__________________________________________;符合条件的D物质可能是________(填序号)。
①硫酸②醋酸③氢氧化钠④一水合氨⑤氯化钡
我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为: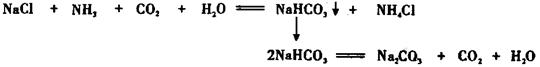
某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
(1)一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
试回答下列有关问题: ①乙装置中的试剂是;
①乙装置中的试剂是;
②丁装置中稀硫酸的作用是;
(2)另一位同学用图中戊装置(其它装置未画出)进行实验。
①实验时,须先从管通入气体,再从管中通入气体;
②有同学建议在戊装置的b管下端连接己装置,理由是。
(10分)乱扔废旧电池会导致严重的环境污染,一节废电池就是一颗“炸弹”。某同学用废干电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如下实验: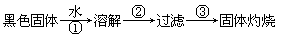
(1)上述三步操作中都用到的一种玻璃仪器是________________。
(2)将灼烧后的固体移入试管,滴加双氧水,能迅速产生一种使余烬的木条复燃的气体,由此推断黑色固体中含有MnO2,它在该反应中的作用为____________。MnO2有一定的氧化性,请写出一个MnO2作氧化剂的反应的化学方程式:______________________________。
(3)验证步骤②的滤液中含有 ,下面是某一实验方案记录片段.请填写下列空白:
,下面是某一实验方案记录片段.请填写下列空白:
实验过程:________________________________________________________。
实验现象:有刺激性气味的气体产生。
写出该实验中反应的离子方程式:_____________________________________。
氮及其化合物与人类各方面有着密切的联系。
Ⅰ.将一支充满标准状况下的NO2的试管倒置于水槽中,则试管中溶液的物质的量浓度为(假设试管中的溶液不扩散);若试管中混有N2O4气体,则试管中溶液的物质的量浓度将。(填偏大、偏小或不变)
Ⅱ.目前,消除氮氧化物污染有多种方法。
(1)用NH3转化法,在催化剂条件下可将NO、NO2转化成无毒的气体。写出NH3 与NO2反应的化学方程式并标出电子转移方向和数目。
(2)用VLNaOH溶液完全可以吸收含aL NO、bL NO2、cL N2O4的混合气体(标准状况下),则NaOH溶液的物质的量浓度至少为。
已知:2NO2+2NaOH=NaNO2+ NaNO3+H2O; NO+NO2+2NaOH=2NaNO2+H2O