【化学一有机化学基础】
苹果中富含对人体有益的苹果酸,可用乙酸和X为原料按如下线路合成: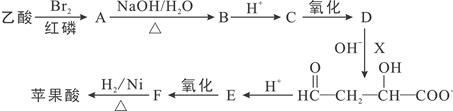
已知: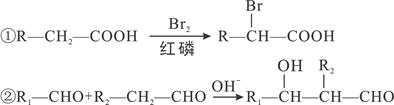
请回答下列问题:
(1)乙酸→A的反应类型 。
(2)写出X的结构简式 。
(3)F中有 种官能团。
(4)有关E的下列说法不正确的是( )
| A.能发生银镜反应 | B.1mol E能与2molH2反应 |
| C.能发生消去反应 | D.能与FeCl3溶液发生显色反应 |
(5)A→B反应的化学方程式 。
(6)苹果酸可发生分子内酯化反应,形成的环状酯有 (写结构简式)。
实验题:将V1 mL 1.0 mol·L-1HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。请按要求填空:
(1)该实验表明此反应(填吸收、释放)能量,即:能可以转化为能,通过图示分析可以得出:做该实验时,环境温度(填高于、低于、等于)22 ℃;
(2)根据图示计算该NaOH溶液的浓度约是mol·L-1
(3)如图所示,在锥形瓶放置有装有水的小试管,往小试管中分别加入下列物质时:①烧碱固体 ②浓硫酸 ③硝酸铵固体 ④NaCl固体,其中能使a端液面高于b端液面的是_________(填序号)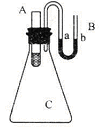
根据下面的描述,按照要求回答下列问题
(1)画出H2O2的电子式:__________
(2)请画出HClO的电子式:__________
(3)用电子式表示出离子化合物MgCl2的形成过程__________
(4)在短周期元素中,由三种非金属元素组成的既有离子键又有共价键,且阴阳离子含电子总数相等的物质,其化学式是__________,画出电子式_________
(5)某学生在一次探究“制取氢气最适宜的金属”的实验时,测得镁在与稀硫酸反应,10 s末硫酸的浓度减少了0.6 mol·L-1,若不考虑反应过程中溶液体积的变化,则10 s内生成硫酸镁的平均反应速率是__________mol·L-1s-1。
根据元素周期表1~18号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有________种,金属性最强的元素与氧气反应生成的化合物有___________(填两种化合物的化学式)。
(2)属于稀有气体的是___________(填元素符号,下同)。
(3)形成化合物种类最多的两种元素是__________________。
(4)第三周期中,原子半径最大的是(稀有气体除外)______________。
(5)推测Si、N最简单氢化物的稳定性_______>_________(用化学式表示)。
推断题科学家们在探索生命奥妙过程中,认识到生命细胞的组成和元素周期律有密切的关系,约占人体质量99.97%的11种大量元素全部位于周期表前20号元素,其余的是十多种人体不可缺少的微量元素。现有a~g 7种短周期元素,是氧、硫、钾、钙外的其它大量元素,它们在元素周期表中的位置如下,并据此回答下列问题:
| a |
|||||||
| d |
e |
||||||
| b |
c |
f |
g |
(1)元素的原子间最容易形成离子键的是下列中的(填选项),元素的原子间最容易形成共价键的是下列中的(填选项)。
A、c和f B、b和g C、d和gD、b和e
(2)下列由a~g形成的各分子中所有原子都满足最外层为8电子结构的是(填选项)
A、ea3 B、ag C、fg3 D、dg4
某酸是一种常见的有机酸,其结构为:
(1)此有机酸含有的官能团名称是____________;在一定条件下,此有机酸可发生化学反应的类型有 ________(填序号);
| A.水解反应 |
| B.取代反应 |
| C.加成反应 |
| D.消去反应 |
E.加聚反应
F.中和反应
(2)下列物质与此酸互为同分异构体的是_____________(填序号);




(3)写出此有机酸与足量的金属钠发生反应的化学方程式:__________________________;