某学生设计了三个实验方案,用以检验淀粉的水解情况。
(1)方案甲:
淀粉液 水解液
水解液 中和液
中和液 溶液变蓝。结论:淀粉没有水解。
溶液变蓝。结论:淀粉没有水解。
(2)方案乙:
淀粉液 水解液
水解液 无红色沉淀。结论:淀粉完全没有水解。
无红色沉淀。结论:淀粉完全没有水解。
(3)方案丙:
淀粉液 水解液
水解液 中和液
中和液 有红色沉淀。结论:淀粉已水解。
有红色沉淀。结论:淀粉已水解。
(4)方案丁:
结论:淀粉部分水解。
以上四种方案的设计及结论是否正确?如不正确,请简述理由。
某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
实验记录如下:
| 实验操作 |
实验现象 |
|
| Ⅰ |
打开活塞a,滴加氯水,关闭活塞a |
A中溶液变为红棕色 |
| Ⅱ |
吹入热空气 |
A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
| Ⅲ |
停止吹入空气,打开活塞b,逐滴加入H2O2溶液 |
开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
请回答下列问题:
(1)A中反应的离子方程式是______________________________。
(2)实验操作Ⅱ吹入热空气的目的是________________________。
(3)装置C的作用是______________,C中盛放的药品是______________________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式___________________。
(5)由上述实验得出的结论是______________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是__________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):_____________________。
某兴趣小组拟制备K3[Fe(C2O4)3]·3H2O晶体
Ⅰ.查阅资料
K3[Fe(C2O4)3]·3H2O是翠绿色晶体,易溶于水,难溶于乙醇,具有光敏性,光照分解。
110℃失去结晶水,230℃时分解。K3[Fe(C2O4)3]·3H2O的摩尔质量是491g/moL
Ⅱ.制备产品
实验步骤如下:
① 取27.8gFeSO4·7H2O和K2C2O4反应生成草酸亚铁
② 将草酸亚铁(FeC2O4)和适量K2C2O4的混合溶液置于40℃的恒温水浴中,逐滴加入 6% H2O2,边加边搅拌,使Fe2+充分被氧化。反应体系中生成K3[Fe(C2O4)3]的同时还有部分Fe(OH)3沉淀
③ 向②所得浊液中加入1mol/LH2C2O4溶液,使溶液变为翠绿色
④ 加热浓缩,冷却结晶,过滤,洗涤,干燥,称量产品的质量为ag
请回答下列问题:
(1)第②步需要控制水浴40℃,温度不能太高的主要目的: ,若第④步冷却时间较长,需将溶液置于冷暗处,原因是: 。
(2)第②步中,为检验Fe2+是否已完全被氧化,可选用 。试剂(填字母)
| A.NaOH溶液 | B.K3Fe(CN)6溶液 | C.苯酚溶液 | D.KSCN溶液 |
(3)请写出第③步中加入H2C2O4溶液将Fe(OH)3沉淀反应生成K3[Fe(C2O4)3]的化学反应方程式: 。
(4)步骤④中的实验操作需要下列仪器中的 (填仪器的编号).
①酒精灯 ②燃烧匙 ③烧杯 ④广口瓶 ⑤研钵 ⑥玻璃棒
(5)有同学为提高产率,避免第④步加热浓缩过程中K3[Fe(C2O4)3]的少量分解,依据查阅的资料提出新的结晶方案:将步骤③得到的溶液中加入 ,过滤,洗涤,干燥,称量。
用中和滴定法测定烧碱的纯度(烧碱中的杂质不和酸反应),请根据实验回答:
(1)将称量好的8.8g烧碱样品配制成500mL待测液,配制过程使用的主要仪器除500mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是___________。
(2)用_______式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞。
(3)用0.20mol•L-1的标准盐酸滴定待测液,判断滴定终点的现象是:_________。
(4)如果实验操作正确,从滴定开始到结束,溶液中的离子浓度关系可以出现的是_______(填答案字母序号)
A.c(Na+)>c(Cl-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(Cl-)>c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(Cl-)
D.c(Cl-)+c(Na+)>c(OH-)+c(H+)
(5)根据下列数据计算,c(NaOH)_______mol/L,烧碱的纯度为________%(保留整数)
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
10.00 |
0.60 |
20.50 |
| 第二次 |
10.00 |
3.00 |
23.10 |
(6)经过分析发现,本次实验的测定结果比烧碱的实际纯度偏高,造成误差的可能原因是_________(填答案字母序号,错选此题为0分)
A.滴定前平视,滴定后俯视
B.未用标准液润洗滴定管
C.用待测液润洗锥形瓶
D.不小心将标准液滴在锥形瓶外面
E.滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁
F.滴定前尖嘴有气泡,滴定后消失
工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下: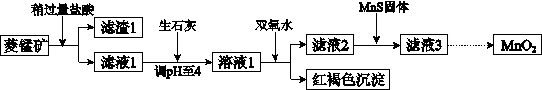
已知:生成氢氧化物沉淀的pH
| Mn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
Cu(OH)2 |
|
| 开始沉淀时 |
8.3 |
6.3 |
2.7 |
4.7 |
| 完全沉淀时 |
9.8 |
8.3 |
3.7 |
6.7 |
注:金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是 。
盐酸溶解MnCO3的化学方程式是 。
(2)向溶液1中加入双氧水时,反应的离子方程式是 。
(3)将MnCl2转化为MnO2的一种方法是氧化法。其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:□Mn2++□ClO3-+□H2O=□Cl2+□________+□________。
(4)将MnCl2转化为MnO2的另一种方法是电解法。
① 生成MnO2的电极反应式是 。
② 若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。检验Cl2的操作是 。
③ 若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。其原因是 。
绿矾(FeSO4•7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体,反应原理为:
(NH4)2SO4+FeSO4+6H2O=(NH4)2SO4•FeSO4•6H2O↓。其流程可表示为:
(1)洗涤中Na2CO3的主要作用是 。
(2)结晶过程中要加热蒸发溶剂,浓缩结晶。应加热到 时,停止加热。
(3)过滤是用下图装置进行,这种过滤跟普通过滤相比,除了过滤速度快外,还有一个优点是 。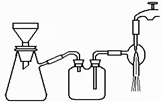
(4)用无水乙醇洗涤的目的是 。
(5)产品中Fe2+的定量分析:制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性条件下KMnO4标准液滴定的方法。称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mol·L-1 KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积 10.00 mL。
①本实验的指示剂是 。
| A.酚酞 | B.甲基橙 | C.石蕊 | D.不需要 |
②产品中Fe2+的质量分数为 。