T℃时,将3mol气体A和1mo1气体B通入容积为2L且固定不变的密闭容器中,发生如下反应:3A(g)+B(g) 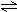 xC(g),2min时反应达到平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写下列空白:
(1)从反应开始到平衡状态,生成C的平均速率为 ;X= ;
(2)若向原平衡混合物的容器中再充入amolC,在T℃达到新的平衡,此时B的物质的量为n(B)= ;
(3)保持温度和容积不变,对原平衡混合物中三者的物质的量作如下调整,可使平衡
向右移动的是 ;
A.均减半 B.均加倍 C.均增加0.4mol D.均减少0.4mol
(4)若上述可逆反应的热化学方程式为:
3A(g)+B(g) 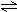 xC(g) ;△H =-QKJ/mol (Q>0)
xC(g) ;△H =-QKJ/mol (Q>0)
①若可逆反应达到平衡后升高体系温度,正反应速率 (填“增大”、“减小”或“不变”),平衡将 (填“左移”、“右移”或“不移动”)
②若可逆反应达到平衡后增大压强,则体系温度将 (填“升高”、“降低”或“不变”)
③若可逆反应达到平衡后,加入A,则△H (填“变大”、“变小”或“不变”
化学式为C8H10O的化合物A具有如下性质:
⑤脱水反应的产物,经聚合反应可制得一种塑料制品(它是目前造成“白色污染”的主要污染源之一)
试回答下列问题:
(1)根据上述信息,对该化 合物的结构可作出的判断是__________(填编号);
合物的结构可作出的判断是__________(填编号);
| A.苯环上直接连有羟基 | B.苯环侧链末端有甲基 |
| C.肯定有醇羟基 | D.肯定是芳香烃 |
(2)化合物A的结构简式为:_______________________;
(3)A和金属钠反应的化学方程式是:__________________________________________________。
(8分)有机物A与乙酸无论以何种比例混合,只要总质量一定,完全燃烧后产生的水的质量也一定,回答:
⑴满足题干条件的A应与乙酸具有相同的___________________。
(2) 若A与乙酸相对分子质量相等,且既能发生银镜反应又能发生酯化反应,则A的结构简式为_____________。
(3)若A由四种元素形成的两种官能团组成,相对分子质量与乙酸相等,且分子中氢原子都不与碳原子相连,则A的结构简式为_____________。
(4)若A分子中氧元素质量分数为13.33%,其余为C、H且其原子个数比为1:1,,且A的相对分子质量小于200,则A的分子式为___________。
下表中括号内物质为所含的少量杂质,请选用适当的试剂和分离装置将杂质除去,并将所选的试剂及装置的编号填入表中:
试剂:①水②氢氧化钠③溴水分离装置:A.分液装置 B.蒸馏装置 C.洗气装置
| 需加入的试剂 |
分离装置 |
|
| 苯(乙醇) |
||
| 乙烷(乙烯) |
||
| 乙醇(乙酸) |
(6分)在一定温度下将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白:
2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白:
(1)用B表示的平均反应速率为____________, A的转化率为____________。
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密 度____________,混合气体平均相对分子质量____________(填“增大”、“减少”或“不变”)。
度____________,混合气体平均相对分子质量____________(填“增大”、“减少”或“不变”)。
(3)若开始时只加C和D各4/3 mol,要使平衡时各物质的物质的量原平衡相等,则还应加入____________ mol B物质。
(4)若向原平衡体系再投入1 mol A和1 mol B,平衡_______(填“右移、左移或不移”)。
在25mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示,
(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式 ;
(2)该氢氧化钠溶液的物质的量浓度为mol/L;
(3)在B点,a12.5ml(填“大于”、“小于”或“等于”,下同)。若由体积相等的氢氧化钠和醋酸混合而且恰好呈中 性,则混合前c(NaOH)c(CH3COOH),混合前酸中 c(H+)和碱中c(OH-)的关系:c(H+)c(OH-);
性,则混合前c(NaOH)c(CH3COOH),混合前酸中 c(H+)和碱中c(OH-)的关系:c(H+)c(OH-);
(4)在D点溶液中离子浓度大小关系为 。