经分析知,某工厂的废水中含有Zn2+、Cu2+、Hg2+、Fe3+离子,请你设计一个回收并分别得到Cu和Hg的实验方案。(要求:写出简明的操作步骤和有关的离子方程式)
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。 (1)T业上用黄铁矿(FeS2)在高温下和氧气反应制备SO2:4FeS2+11O2 8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2. 75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。
8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2. 75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率(已知SO3。熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响)。
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是______。
②当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是______。
③实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此条件下二氧化硫的转化率是______(用含字母的代数式表示,不用化简)。
(3)某兴趣小组欲在绿色环保的条件下探究SO2的性质,设计如下图实验装置。
B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为_______;
C中反应的离子方程式为______ ;D中的实验现象为______ ;E装置的作用是______。
硫代硫酸钠(Na2S2O3)俗称大苏打,照相业中用作定影剂。Na2S2O3易溶于水,在酸性溶液中与酸反应有单质硫和SO2生成。
(1)Na2S2O3溶液与稀硫酸混合反应可用于探究外界条件对反应速率的影响,完成有关的实验设计表(已知各溶液体积均为5 mL):
| 实验编号 |
T/K |
c(Na2S2O3)/ mol·L-1 |
c(H2SO4)/ mol·L-1 |
实验目的 |
| ① |
298 |
0.1 |
0.1 |
实验①和②探究温度对该反应速率的影响; 实验①和③探究反应物浓度对该反应速率的影响 |
| ② |
308 |
|||
| ③ |
0.2 |
(2)Na2S2O3还具有很强的还原性,Na2S2O3溶液与足量氯水反应的化学方程式为:
________(提示:S元素被氧化为SO42-)。
(3)现有一瓶Na2S2O3固体,可能含有Na2SO4固体,请设计实验验证,写出实验步骤、预期现象和结论。限选试剂:1 mol·L-1 H2SO4、1 mol·L-1 HNO3、1 mol·L-1 HCl、1 mol·L-1 NaOH、0.1 mol·L-1 Ba(NO3)2、0.1 mol·L-1 BaCl2、0.01 mol·L-1 KMnO4、蒸馏水。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量固体于试管A中,加蒸馏水溶解。 |
|
| 步骤2:向试管A加入 |
|
| 步骤3:取步骤2的少量上层清液于试管B中, |
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下: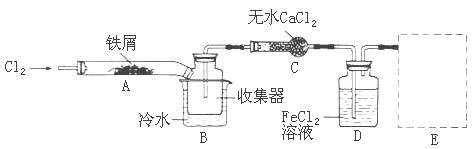
①检查装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成
④ ……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封
请回答下列问题:
(1)写出FeCl3溶液吸收有毒的H2S的离子方程式为
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A的右端。要使沉积得FeCl3进入收集器,第④步操作是
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)
(4)装置B中的冷水作用为;装置C的名称为;装置D中FeCl2全部反应完后,因为失去吸收Cl2的作用而失效,从下面选出检验FeCl2是否完全失效的试剂:___
| A.氢氧化钠溶液 | B.酸性高锰酸钾溶液 | C.硫氰化钾溶液 | D.氨水 |
(5)在虚线框内画出尾气吸收装置E并注明试剂。
某研究小组模拟工业处理电镀含氰废水并测定处理的效率,利用下图所示装置进行实验。将CN-的浓度为0.2 mol·L-1的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②三颈烧瓶中,充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。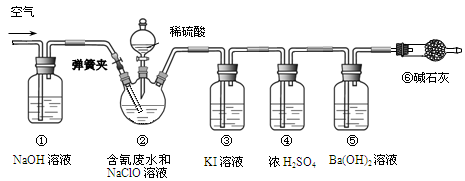
已知装置②中发生的主要反应依次为:CN-+ ClO-=CNO-+ Cl- 2CNO-+2H+ +3C1O-=N2↑+2CO2↑+3C1-+H2O
(1)①和⑥的作用是。
(2)装置②中,生成需由装置③除去的物质的离子方程式为。
(3)反应结束后,缓缓通入空气的目的是。
(4)为计算该实验中含氰废水被处理的百分率,需要测定的质量。
(5)已知CN-的处理效率可高达90%,产生的CO2在标准状况下的体积为。
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图1、2所示的实验。请回答相关问题。
(1)定性分析:如图1可通过观察,定性比较得出结论。有同学提出将FeCl3改为0.05 mol/L Fe2(SO4)3更为合理,其理由是。
(2)定量分析:如图2所示,实验时均生成40 mL气体,其它可能影响实验的因素均已忽略。实验中需要测量的数据是。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示。
①写出H2O2在二氧化锰作用下发生反应的化学方程式。
②实验时放出气体的总体积是mL。
③A、B、C、D各点反应速率快慢的顺序为:>>>。
解释反应速率变化的原因。
④H2O2的初始物质的量浓度是(请保留两位有效数字)。