二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。 (1)T业上用黄铁矿(FeS2)在高温下和氧气反应制备SO2:4FeS2+11O2 8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2. 75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。
8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2. 75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率(已知SO3。熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响)。
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是______。
②当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是______。
③实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此条件下二氧化硫的转化率是______(用含字母的代数式表示,不用化简)。
(3)某兴趣小组欲在绿色环保的条件下探究SO2的性质,设计如下图实验装置。
B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为_______;
C中反应的离子方程式为______ ;D中的实验现象为______ ;E装置的作用是______。
某课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下3 组实验,如图Ⅰ~III 所示。
(1)Ⅰ所示的实验,若固体质量相同且稀盐酸足量时,气球鼓起较小的是___________(填化学式)。
(2)II、III 所示的实验均能鉴别这两种物质,相关反应的化学方程式是①_____________、②_________________。
③与II 相比, III 的优点是______________________(填选项序号)。
a.III 比II 复杂
b.III 比II 安全
c.III 可以做到用一套装置同时进行两个对比实验,而II 不行
(3)若用III 验证碳酸钠和碳酸氢钠的热稳定性,则试管B 中装入的固体应该是_______________。
某科研小组探究工业废Cu粉(杂质可能含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO4·5H2O,实现废物综合利用。他们进行了两组实验,过程如下:
过程Ⅰ:
过程Ⅱ:
(1)废Cu粉中一定含有的杂质是___________________(填化学式);
(2)写出过程①③中可能发生的所有反应的离子方程式:
①_______________________________________;
③_______________________________________;
(3)综合过程Ⅰ、II,计算该9.4g废Cu粉中,m(SiO2)=_________,m(Cu)= _________;
有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器已略)。实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内.在玻璃反应管内装入适量水(使钠块不与水接触).实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内。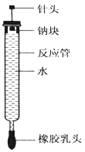
(1)钠与水反应的离子方程式为______________________;
(2)实验中“钠块熔化为闪亮的小球”说明____________________;向烧杯中的溶液中滴加________________,溶液变红,说明钠与水反应生成碱性物质;
(3)如果实验前加入反应管内水的体积为amL,欲使水最终全部被排出,则所取金属钠的质量至少为_______ g(设当时实验条件下气体摩尔体积为VmL/mol)。
某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其它铁的化合物。某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了以下探究:
请回答下列问题:
Ⅰ.(1)实验时用10mol•L-1的浓硫酸,配制100mL 1mol•L-1 H2SO4溶液,所需浓硫酸的体积为_________mL;
(2)下列操作中,容量瓶所具备的功能有(填序号);
A.配制一定体积准确浓度的标准溶液
B.长期贮存溶液
C.常用来代替量筒量取一定体积的液体
D.用来溶解固体溶质
(3)在下列配制过程示意图中,有错误的是__________(填写序号);
(4)下列说法正确的__________
A.洗涤烧杯2~3次,并将洗涤液移入容量瓶以减少误差
B.某同学将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低
C.定容时仰视观察,所配溶液浓度会偏低
Ⅱ.(1)步骤②加入过量H2O2后,溶液中主要存在的金属阳离子是_____________;
(2)从红褐色的悬浊液到最后的称量,其过程中所需的基本操作为:
a.__________,b.洗涤,c.灼烧,d.冷却
(3)若称得固体的质量为ag,则每片补血剂中含硫酸亚铁的质量为__________g。
某学生对Na2S03与AgN03在不同pH下的反应进行探究
(1)测得Na2S03溶液pH=10,AgNO3溶液pH=5,二者发生水解的离子分别是__________;
(2)调节pH,实验记录如下:
| 实验 |
pH |
现象 |
| a |
10 |
产生白色沉淀,稍后溶解,溶液澄清 |
| b |
6 |
产生白色沉淀,一段时间后,沉淀未溶 |
| c |
2 |
产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
①Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液
②Ag2O棕黑色,不溶于水,能和酸反应,它和盐酸反应的化学方程式为 。
(3)该同学推测a中白色沉淀为Ag2SO4,依据是空气中的氧气可能参与反应,则生成硫酸银沉淀的离子方程式为 。
该同学设计实验确认了a、b、c中的白色沉淀不是Ag2SO4,实验方法是:取b、c中白色沉淀, 置于Na2SO3溶液中,沉淀溶解。另取Ag2SO4固体置于足量 溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
Ⅱ.向x中加人过量浓HNO3,产生红棕色气体。
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀.
①实验I的目的是 。
②根据实验现象,分析X是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,+4价硫的还原性增强,能被+1价银氧化。通过进一步实验确认了这种可能性,实验如下: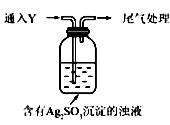
①通人Y后,瓶中白色沉淀转化为棕黑色,气体Y是 。
②白色沉淀转化为X的化学方程式是 。