将1 mol I2(g)和2 mol H2置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) 2HI(g)ΔH<0,并达到平衡。HI的体积分数w(HI)随时间t变化如图曲线(Ⅰ)所示。
2HI(g)ΔH<0,并达到平衡。HI的体积分数w(HI)随时间t变化如图曲线(Ⅰ)所示。
(1)达到平衡时,I2(g)的物质的量浓度为______________mol·L-1。
(2)若改变反应条件,在甲条件下w(HI)的变化如图曲线(Ⅱ)所示,在乙条件下w(HI)的变化如图曲线(Ⅲ)所示。则甲条件可能是______________,乙条件可能是______________。(填入下列条件的序号)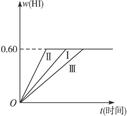
①恒容条件下,升高温度 ②恒容条件下,降低温度 ③恒温条件下,缩小反应容器体积 ④恒温条件下,扩大反应容器体积 ⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g),b mol H2(g)和c molHI(g)(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是_____________________________。
一定量的液态化合物XY2,在一定量O2中恰好完全反应:
XY2(液)+ 3O2(气)= XO2(气)+ 2YO2(气)
冷却后在标准状况下,测得生成物的体积为672mL,密度为2.56g/L。则:
(1)反应前O2在标准状况下的体积是mL;
(2)化合物XY2的摩尔质量是。
铜与浓硝酸反应的化学方程式如下:Cu +4HNO3(浓)==Cu(NO3)2+2 NO2↑+2H2O将 3.2 g铜完全溶于足量的 50 mL 11.0 mol•L-1的浓硝酸中,只生成NO2气体,假设反应后溶液的体积仍为 50 mL。试计算
(1)反应后可生成标准状况下NO2气体多少 L? (写计算过程)
(2)反应后溶液中NO3-物质的量浓度为_________________________。
取NaHCO3和Na2O2的固体混合物x g放入一密闭容器中加热至250℃,充分反应后排出所有气体。将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀。另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如下图所示。试回答下列问题: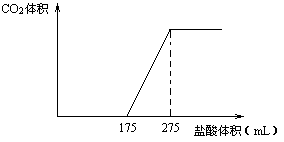
(1)加入盐酸后总共产生的气体在标准状况下的体积为__________________L;
(2)盐酸中HCl的物质的量浓度__________________;
(3)反应后的固体的成分(填化学式)__________________;
(4)密闭容器中排出气体的成分(填化学式)______________;
(5)x=_____________。
现有25℃时pH=12的NaOH溶液100ml,欲用以下几种方法将其pH调为11,回答下列问题。(假设稀溶液混合后的总体积等于两溶液的体积之和)
(1)此pH=12的NaOH溶液中由水电离产生的c(H+)=;
(2)加水稀释,需加水的体积为ml;
(3)加入pH=2的盐酸,需加盐酸的体积为ml;
(4)加入pH=10的NaOH溶液,需加NaOH溶液的体积为ml;
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为 (阿伏伽德罗常数用NA表示),放出的热量为 kJ。
(2)已知:C3H8(g ) ==== CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ·mol-1
CH3CH=CH2(g) ==== CH4(g)+HC≡CH(g)△H2=32.4kJ·mol-1
则相同条件下,反应C3H8(g)====CH3CH=CH2 (g)+H2(g)的△H=kJ·mol-1。
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如右表:已知1molH2O(g)转变为1molH2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式。
| 物质 |
燃烧热(kJ·mol-1) |
| H2(g) |
-285.8 |
| CO(g) |
-283.0 |
| CH4(g) |
-890.3 |
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。请写出该电池的正极反应式。