根据如图及描述,回答有关问题:
(1)关闭图A装置中的止水夹a后,从长颈漏斗向试管中注入一定量的水,静置后如图所示。试判断:A装置是否漏气?__________(填“漏气”“不漏气”或“无法确定”),做出该判断的理由是____________________。
(2)关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶。试判断B装置是否漏气?__________(填“漏气”“不漏气”或“无法确定”),做出该判断的理由是____________________。
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量,某实验小组做了如下实验:
步骤一:称量5.40g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入适量锌粉使Fe3+全部转化为Fe2+,同时有气泡产生,过滤,洗涤,将过滤及洗涤所得溶液A收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定溶液A至终点,消耗KMnO4溶液21.98ml,反应中MnO4-被还原成Mn2+ 。
重复步骤二、步骤三操作,消耗0.010mol/L KMnO4溶液22.02ml。
请回答下列问题:
①配制三草酸合铁酸钾溶液的操作依次是:称量、溶解、冷却、转移、洗涤、、摇匀。
②“步骤一”所得溶液的颜色为。
③写出“步骤二”中加锌粉产生气泡的离子方程式;
写出“步骤二”中Fe3+转化为Fe2+的离子方程式。
④“步骤三”KMnO4溶液应装在式滴定管中;检查该滴定管不漏水,用水洗净后,装入KMnO4标准溶液前,要对该滴定管进行的操作是 ;
判断滴定至终点依据的现象是 。
⑤实验测得该晶体中铁的质量分数为。
某研究小组探究SO2和Fe(NO3)3溶液的反应。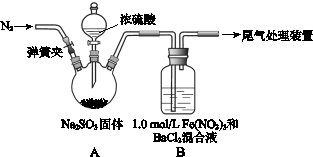
已知: 1.0 mol·L-1的Fe(NO3)3溶液的pH=1,请回答:
(1)装置A中反应的化学方程式是。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是。
(3)装置B中产生了白色沉淀,其成分是,说明SO2具有性。
(4)分析B中产生白色沉淀的原因:
观点1:_____________________________;
观点2:SO2与Fe3+反应;
观点3:在酸性条件下SO2与NO3-反应;
①若观点2正确,装置B中反应的离子方程式是。
②只需将装置B中的 Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,即可证明观点3是否正确,应选择的试剂是(填序号)。
a.0.1 mol·L-1稀硝酸
b.1.5 mol·L-1 Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol/L盐酸等体积混合的溶液
工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
CH3COOH(l)+C2H5OH(l) CH3COOC2H5(l)+H2O(l)ΔH=-8.62kJ·mol-1
CH3COOC2H5(l)+H2O(l)ΔH=-8.62kJ·mol-1
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78℃和77℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示。
(1)该研究小组的实验目的是__________________。
(2)60℃下反应40min与70℃下反应20min相比,前者的平均反应速率___________后者(填“小于”、“等于”或“大于”)。
(3)如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是______(写出两条)。
(4)某温度下,将0.10 mol CH3COOH溶于水配成1 L溶液。
①实验测得已电离的醋酸分子占原有醋酸分子总数的1.3%,则该温度下CH3COOH的电离平衡常数K=____________________。(水的电离忽略不计,醋酸电离对醋酸分子浓度的影响忽略不计)
②向该溶液中再加入__________mol CH3COONa可使溶液的pH约为4。(溶液体积变化忽略不计)
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示: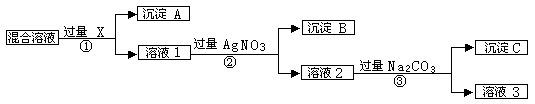
请回答下列问题:
⑴ 写出实验流程中下列物质的化学式试剂X:_______________ 沉淀A:_______________沉淀B:______________
⑵ 上述实验流程中加入过量的Na2CO3的目的是_______________________________。
⑶ 按此实验方案得到的溶液3中肯定含有_________________(填化学式)杂质。
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。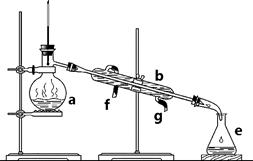
I II
⑴ 写出下列仪器的名称:a. ____________ b. _____________ c. ______________
⑵ 仪器a~e中,使用前必须检查是否漏水的有_______________。(填序号)
⑶ 若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是______________,将仪器补充完整后进行实验,温度计水银球的位置在_____________________处。冷凝水由________(填f或g)口通入,_________口流出。
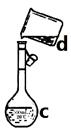
⑷ 现需配制0.1 mol/LNaOH溶液500 mL,装置II是某同学转移溶液的示意图。
① 图中的错误是________________________________________。除了图中给出的的仪器和分析天平外,为完成实验还需要的仪器有:_______________________________。
② 根据计算得知,所需NaOH的质量为_____________ g
③ 配制时,正确操作顺序是(字母表示,每个字母只用一次)__________________。
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
| B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 |
| C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处