糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是
| A.植物油不能使溴的四氯化碳溶液褪色 |
| B.淀粉水解的最终产物是葡萄糖 |
| C.葡萄糖能发生氧化反应和水解反应 |
| D.天然蛋白质遇到硝酸银溶液后产生的沉淀能重新溶于水 |
【3分】某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是( )
A.K+、Na+、 、 、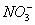 |
B.Na+、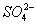 、Cl-、ClO- 、Cl-、ClO- |
C.H+、Mg2+、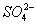 、 、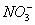 |
D.Ag+、K+、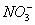 、Na+ 、Na+ |
【3分】下列关于物质分类的正确组合是( )
| 分类 组合 |
碱 |
酸 |
盐 |
碱性氧化物 |
酸性氧化物 |
| A |
纯碱 |
盐酸 |
烧碱 |
氧化铝 |
二氧化碳 |
| B |
烧碱 |
硫酸 |
食盐 |
氧化镁 |
一氧化碳 |
| C |
苛性钠 |
醋酸 |
萤石 |
过氧化钠 |
二氧化硫 |
| D |
苛性钾 |
油酸 |
苏打 |
氧化钠 |
硫酐 |
【3分】硫代硫酸钠(Na2S2O3)可作为脱氯剂,已知25 mL 0.1 mol·L-1该溶液恰好把标准状况下的224 mL氯气完全还原,则产物中硫元素的化合价为( )
| A.-2 | B.0 | C.+4 | D.+6 |
2005年1月,欧洲航天局的惠更斯号探测器首次成功登陆土星的最大卫星——土卫六。科学家对探测器发回的数据进行了分析,发现土卫六的大气层中含有95%的氮气,剩余的气体为甲烷和其他碳氢化合物。下列关于碳氢化合物的叙述正确的是()
| A.碳氢化合物的通式为CnH2n+2 | B.石油的主要成分是碳氢化合物 |
| C.乙炔是含碳量最高的碳氢化合物 | D.碳氢化合物中的化学键都是极性键 |
常温下将稀NaOH溶液和稀CH3COOH溶液混合,不可能出现的结果是()
| A.pH>7,且c(OH-)>c(Na+)> c(H+)>c(CH3COO-) |
| B.pH>7,且c(Na+)+c(H+)=c(CH3COO—)+c(OH-) |
| C.pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| D.pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-) |