分别取1 mol葡萄糖进行下列实验:
(1)与银氨溶液发生银镜反应,能还原得到__________ mol银单质,反应后葡萄糖变为(结构简式)__________。
(2)与醋酸发生酯化反应,需__________ g醋酸才能完全酯化。
(3)若使之完全转化为H2O和CO2,所需O2的体积(标准状况)为__________ L。
(4)与新制Cu(OH)2悬浊液反应的化学方程式为_________________________________。
一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液。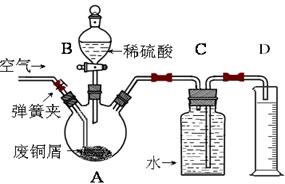
(1)向A中加入10g废铜屑样品,关闭弹簧夹,打开B活塞向A注入足量稀硫酸后关闭。此时装置C中发生的现象是。
(2)反应进行到A中不再产生气泡时,拆除C、D装置后,为了使A中固体全部消失,①接下来的操作是:______________________________。
②该过程中发生反应的离子方程式是;
③为使A中固体加快溶解速率,以下方法运用合理的是。
a. 对A装置加热
b. 向A内加入少量Fe2O3
c. 向A内加入少量CuO
d. 增大空气通入量
e. 向A内加入少量FeSO4
f. 向A内加入少量H2O
(3)待A中固体全部溶解后,再继续通入一段时间空气后,关闭弹簧夹,停止通入空气。将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液,此过程离子反应方程式是__________。
(4)有同学认为,可以不用测量气体法计算废铜屑中铜的质量百分含量,其具体操作步骤可续写为:
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意图如下:
(1)将菱锌矿研磨成粉的目的是________________________。
(2)完成“氧化除铁”步骤中反应的离子方程式:
(3)针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是__________。
(4)根据下表数据,调节“滤液 2”的pH时,理论上可选用的最大区间为________________。
| Mg(OH)2 |
Zn(OH)2 |
MgCO3 |
CaCO3 |
|
| 开始沉淀的pH |
10.4 |
6.4 |
- |
- |
| 沉淀完全的pH |
12.4 |
8.0 |
- |
- |
| 开始溶解的pH |
- |
10.5 |
- |
- |
| Ksp |
5.6×10-12 |
- |
6.8×10-6 |
2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是________(选填序号)。
a.大理石粉b.石灰乳 c.纯碱溶液d.烧碱溶液
(6)“滤液4”之后的操作依次为__________、__________、过滤、洗涤、干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于___________________。
硫代硫酸钠晶体(Na2S2O3·5H2O,式量248)俗称海波或大苏打,它易溶于水,且溶解度随温度升高而显著增大,难溶于乙醇,加热时易分解,可用于照相行业的定影剂。实验室模拟工业制备硫代硫酸钠晶体通常有以下方法,请回答有关问题。
亚硫酸钠法:Na2SO3+S+5H2O=Na2S2O3·5H2O,简易实验流程如下: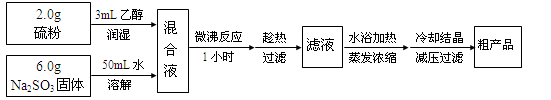
(1)硫粉用乙醇润湿的目的是。
(2)操作中不能将溶液蒸发至干的原因是。
(3)所得粗产品一般通过方法提纯。
硫化碱法:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,主要实验装置如下: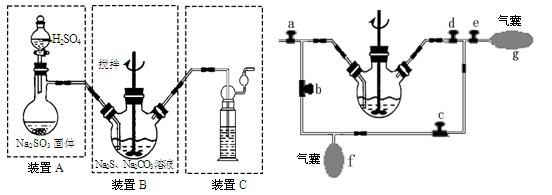
(4)装置C的作用是。
(5)为充分利用SO2,对装置B进行改进(如上右图所示):当A中反应发生后,关闭旋塞b、e,打开a、c、d,往B中溶液通入SO2,未反应的SO2被收集到气囊f中。待f收集到较多气体时(假定此时装置A中反应已停止),关闭旋塞,打开旋塞,轻轻挤压f,使SO2缓缓地压入B中溶液再次反应,未反应的SO2又被收集在气囊g中。再将g中的气体挤压入f中,如此反复,直至完全反应。
(6)为测定硫代硫酸钠晶体粗产品的纯度。某兴趣小组称取5.0克粗产品配成250mL溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.01mol/L KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时到达滴定终点。实验数据如下表:
| 滴定次数 |
1 |
2 |
3 |
| 消耗Na2S2O3溶液(mL) |
19.98 |
21.18 |
20.02 |
①该产品的纯度是。
②可能造成实验结果偏低的有(填编号)。
A.锥形瓶用蒸馏水润洗
B.滴定管未用Na2S2O3溶液润洗
C.滴定终点时俯视读数
D.若滴定前滴定管尖嘴处有气泡,滴定后消失
某课外活动小组对甲酸进行了如下的实验,以验证其含有醛基,并考察其化学性质,首先做了银镜反应。
(1)在甲酸进行银镜反应前,必须在其中加入一定量的,因为。
(2)写出甲酸进行银镜反应的化学方程式。
(3)某同学很成功的做了银镜反应,他肯定没有进行的操作(写字母)
| A.用洁净试管 |
| B.在浓度为2%的NH3·H2O中滴入稍过量的浓度为2%的硝酸银 |
| C.用前几天配制好的银氨溶液 |
| D.在银氨溶液里加入稍过量的甲酸 |
E.用小火对试管直接加热
F.反应过程中,振荡试管使之充分反应
然后,同学们对甲酸与甲醇进行了酯化反应的研究: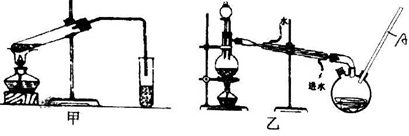
(4)乙装置中长导管A的作用是。
(5)写出甲酸和甲醇进行酯化反应的化学方程式。
(6)选择甲装置还是乙装置好?,原因是。
(7)实验过程中选用的药品及试剂有:浓H2SO4、甲醇、甲酸还有、两种必备用品。
(8)一同学用装有饱和氢氧化钠的三颈瓶接收甲酸甲酯,几乎没有收集到产物,请给予合理的解释。
为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器(内含物质)组装成实验装置: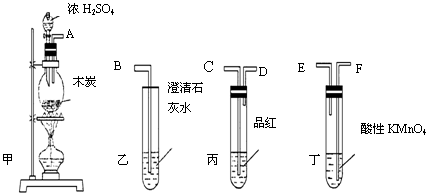
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
接,接,接;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?
乙中,丙中;
(3)丁中酸性KMnO4溶液的作用是;
(4)写出甲中反应的化学方程式。