卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义。
(1)在光照条件下,氯气和氢气反应过程如下:
①Cl2→Cl+Cl ②Cl+H2→HCl+H ③H+Cl2→HCl+Cl
反应②中被破坏的化学键是——,氯元素的原子结构示意图为——。。
(2)二氧化氯(ClO2)是一种广泛用于水处理消毒剂,与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有害的有机氯化物。制备ClO2的方法有以下两种:
2NaClO3+4HCl===2ClO2↑+Cl2+2NaCl+2H2O…………………………①
2NaClO2+H2O2+H2SO4===2C1O2↑+O2↑+Na2SO4+2H2O …………………②
你认为哪种方法最佳 (填序号),理由是 。
(3)工业上用电解饱和食盐水的方法制取烧碱和氯气,请写出反应的离子方程式
。
(4)碘钨灯具有比白炽灯寿命长且环保节能的特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)
 WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
或“等于”或“小于”)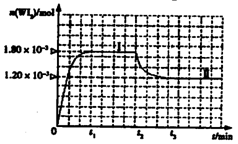
②从反应开始到t1时间内的平均反应速率
v(I2)= 。
③下列说法中不正确的是 (填序号)。
A.该反应的平衡常数表达式是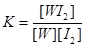
B.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
C.利用该反应原理可以提纯钨
(5)25℃时,向5mL含有KCl和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液,先生成的沉淀是 ,溶液中离子浓度由大到小的顺序是 [不考虑H+和OH-。25℃时KSP(AgCl)=1.8×10-10、KSP(AgI)=8.3×10-17]。
(6)Mg常用作提纯Ti的试剂,已知:
①Mg(s)+Cl(g)==MgCl2(s)△H=—641kJ/mol
②Ti(s)+2Cl2(g)===TiCl2(l) △H=—770kJ/mol
请写出Mg与液态TiCl4反应提纯钛的热化学方程式 。
在Fe(OH)3胶体中,逐滴加入HI稀溶液,会出现一系列变化.
(1)先出现红褐色沉淀,原因是__________________________________.
(2)随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式____________________________.
(3)最后溶液颜色加深,此原因的反应 的离子方程式是________________________
的离子方程式是________________________
(10分)(1)已知下列变化过程中,0.2 mol R2O72-与0.2 mol K2SO3恰好反应,则R被还原的价态为____。
(2)在100 mL 0.100 mol·L-1的FeBr2溶液中通入Cl2,若要使Fe2+刚好反应完全,则需标准状况下C l2________ mL。
l2________ mL。
(3)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.
①已知KBrO3在反应中得到电子,则该反应的还原剂是______________________.
②已知0.2 mol KBrO3在反应中得到1mol电子生成X,则X的化学式为______________.
mol KBrO3在反应中得到1mol电子生成X,则X的化学式为______________.
10.4gR2SO4中含0. 1molR2+,则R2SO4的摩尔质量是;R的相对原子质量是。
某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。实验中加热至恒重的目的是。
(2)方案二:按下图装置进行实验。并回答以下问题:
①实验前应先________________。分液漏斗中应该装___________(填“盐酸”或“稀硫酸盐”)。D装置的作用是_________________________________________;
②实验中除称量样品质量外,还需称________装置(用字母表示)前后质量的变化;
③根据此实验得到的数据,测定结果有较大误差。因为实验装置还存在一个明显缺陷,该缺陷是。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯、漏斗外还用到的玻璃仪器有______________________;
②试验中判断沉淀是否完全的方法是_______________________________________
③若加入试剂改为氢氧化钡,已知称得样品9.5g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为_________________(保留一位小数)。
草酸晶体的化学式可表示为H2C2O4·xH2O,为测定x值进行下列实验:
(1)称取W g草酸晶体,配成100.00 mL溶液。
(2)取25.00 mL所配溶液置于锥形瓶中,加入适量稀硫酸后,用浓度为a mol·L-1KMnO4溶液滴定。KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O(未配平)
回答下列问题:
①实验(1)中,为配制准确的草酸溶液,必须使用的仪器有_____________________________;
②实验(2)中,滴定时,KMnO4溶液应盛在___________中(填酸式或碱式滴定管);
③若滴定用的KMnO4溶液因放置而变质,浓度偏低,则根据实验求出的x值______(填偏高、偏低、无影响);
④滴定终点时,锥形瓶内溶液颜色变化是__________________________________;
⑤若滴定终点时,共用去KMnO4溶液V mL,求草酸溶液的物质的量浓度及x的值:
, .