在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)NO的平衡浓度c(NO)= 。
(2)图中表示NO2变化的曲线是 。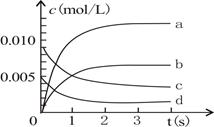
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2)
b.容器内气体总物质的量保持不变
c.v逆 (NO)=2v正(O2)
d.容器内气体的密度保持不变
海带中含有碘元素,碘缺乏者宜多食海带,为检测海带中是否含有碘元素,实验人员将海带在坩埚中烧成灰渣后加水搅拌,使海带中的碘离子溶于水,然后在所得澄清溶液中通入适量氯气,将碘离子转变成单质碘,为进一步检验溶液中单质碘的存在,人们利用碘易溶于四氯化碳溶剂且呈紫红色的特殊性进行确认,最终发现海带中含碘。在上述实验中未提到的两步常见分离操作的名称是:、。
有四种元素A、B、C、D,其中B2-离子与C+离子核外都有二个电子层,B原子的质子数与C原子的质子数之和比D原子的质子数多2,A原子失去一个电子后变成一个质子,试回答:(1)A、B、C、D的元素名称分别为、、、。
(2)B原子的原子结构示意图为,C+离子的结构示意图为。
(1)0.3mol NH3分子中所含质子数与mol H2O分子中所含质子数相等。
(2)已知16克A和20克B恰好完全反应生成0.04mol C和32克D,则C的摩尔质量为________。
(3)如果a g 某气体中含有的分子数为b,则c g 该气体在标准状况下的体积为L(NA表示阿伏加德罗常数的数值)。
晶胞是晶体中最小的重复单元.已知铁为面心立方晶体,其结构如下图甲所示,面心立方的结构特征如下图乙所示.若铁原子的半径为 ,试求铁金属晶体中的晶胞长度,即下图 丙中AB的长度为______________m.
,试求铁金属晶体中的晶胞长度,即下图 丙中AB的长度为______________m.
有一种金属结构单元是一个“面心立方体”(注:八个顶点和六个面分别有一个金属原子)。该单元平均是由__________个金属原子组成的。