[化学一有机化学基础]
X是一种能与FeCl3溶液作用显紫色的重要有机物。

(1)写出E中官能团的名称 ,反应②的反应类型是 。
(2)X的结构简式为 。
(3)写出反应⑤的化学 。
(4)写出满足能与FeCl3溶液发生显色反应且含有 的
的
C(C9H10O3)的同分异构体的结构简式 (写出两种:一种苯环上有四个取代基,一种苯环上有两个取代基)。
A、B、C、D、E是五种短周期的主族元素,它们的原子序数依次增大,A、D都能与C按原子个数比为1:1或2:1形成化合物,A、B组成的气态化合物的水溶液呈碱性,E与C的最外层电子数相同。
(1)A与B形成的化合物中,原子个数比为2:1的化合物的结构式为 。
(2)D与C按原子个数比为1:1形成化合物的电子式是 。
(3)B、C所形成氢化物的稳定性由强到弱的顺序是 、(填具体的化学式)。
(4)F是一种历史悠久、应用广泛的金属元素。若将F金属投入到盐酸溶液中,生成了浅绿色溶液M。写出M的酸性溶液和A与 C形成的一种化合物反应的离子方程式:。
(5)有人设想寻求合适的催化剂和电极材料,以A2、B2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应式:;放电时溶液中H+移向(填“正”或“负”)极。
(6)E(s)+O2(g)EO2(g) △H1 E(g)+O2(g)EO2(g)△H2,则△Hl△H2(填“>”或“<”或“=”)。
U、W、X、Y、Z都是短周期元素,且原子序数依次增大。其中U与W可形成三角锥形分子A,U与X可形成常温下呈液态的分子B,A、B均为10电子分子;Y元素原子的K层电子数与M层电子数相同;Z元素的单质、氧化物均为原子晶体。请回答下列问题:
(1)Z元素在周期表中的位置______________。W、X、Y、Z四种元素的原子半径由小到大的顺序是______________(用元素符号表示)。
(2)用电子式表示U与X形成的18电子化合物的形成过程________。
(3)ZX2与NaOH溶液反应的离子方程式。
(4)一定量的Y单质在足量二氧化碳中充分燃烧的化学方程式是______________,将生成的全部固体与足量的热浓硝酸混合,充分反应后,产物中二氧化碳和二氧化氮共aL(标准状况),则 Y 单质的质量是______________g(用含a的代数式表示)。
以HCHO和C2H2为有机原料,经过下列反应可得化合物N(C4H8O2)。
(1)反应Ⅰ的反应类型为______________。
(2)HOCH2C≡CCH2OH分子的核磁共振氢谱有_______个吸收峰。
(3)化合物M不可能发生的反应是____________(填序号)。
| A.氧化反应 |
| B.取代反应 |
| C.消去反应 |
| D.加成反应 |
E.还原反应
(4)N的同分异构体中,属于酯类的有________种。
(5)A与M互为同分异构体,有如下转化关系。其中E的结构简式为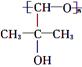
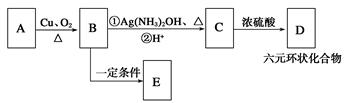
填写下列空白:
①A的结构简式为____________________,B中的官能团名称是____________。
②D的分子式为__________________。
③写出B与银氨溶液反应的化学方程式:。
黄血盐(亚铁氰化钾,K4[Fe(CN)6])易溶于水,广泛用作食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10 mg·kg-1。黄血盐经长时间火炒,超过400 ℃时会分解生成剧毒的氰化钾。
回答下列问题:
(1)写出基态Fe2+的核外电子排布式__________________。K4[Fe(CN)6]中Fe2+与CN-两种离子之间的作用力是__________________。
(2)CN-中碳原子的杂化方式为____________;1 mol CN-中含有π键的数目为__________。
(3)金属钾、铜的晶体的晶胞结构如下图(请先判断对应的图),钾、铜两种晶体晶胞中金属原子的配位数之比为______________。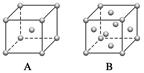
(4)黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与CN-是等电子体的气态化合物,反应化学方程式为________________。
锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下: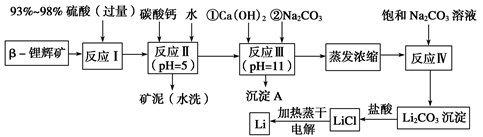
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.7 |
9.6 |
| 完全沉淀pH |
3.7 |
4.7 |
11 |
②Li2CO3在不同温度下的溶解度如下表:
| 温度/℃ |
0 |
10 |
20 |
50 |
75 |
100 |
| Li2CO3的溶解度/g |
1.539 |
1.406 |
1.329 |
1.181 |
0.866 |
0.728 |
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:__________________________。
(2)反应Ⅱ加入碳酸钙的作用是__________________________________。
(3)写出反应Ⅲ中生成沉淀A的离子方程式:________________________。
(4)洗涤所得Li2CO3沉淀要使用________(选填“热水”或“冷水”),你选择的理由是__________________________________。
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是
________________________________________。