某化学小组欲探究①溴乙烷在不同溶剂中与NaOH发生不同类型的反应;②某CuO和Cu混合粉末中CuO的质量分数。下列实验设计方案及预期结论合理的是 ( )
| |
探究 |
方案 |
结论 |
| A |
① |
取2mL溴乙烷,加入适量NaOH水溶液,加热。一段时间后,向溶液中滴加AgNO3溶液,有淡黄色沉淀产生 |
溴乙烷中的溴变成了Br-,溴乙烷与NaOH水溶液发生取代反应 |
| B |
① |
取2mL溴乙烷,加入适量NaOH乙醇溶液,加热,将产生的气体通入KMnO4酸性溶液中,溶液褪色 |
反应生成乙烯,溴乙烷与NaOH乙醇溶液发生消去反应 |
| C |
② |
称取质量为m1的混合物,在空气中加强热至质量不再变化,冷却、称量,所得固体质量为m2 |
CuO的质量分数为: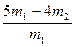 |
| D |
② |
称取质量为m1的混合物,放入足量稀硝酸中溶解,过滤、洗涤、干燥、称量,残留固体质量为m2 |
CuO的质量分数为: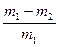 |
化学与生活、科技、技术、社会密切相关,下列有关说法正确的是
| A.可用热的纯碱溶液除油污 |
| B.聚氯乙烯塑料可用于制食品包装袋 |
| C.煤经气化和液化两个物理变化过程,可变为清洁能源 |
| D.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
下列说法正确的是 ( )
| A.垃圾是污染物,一定条件下还可能产生二次污染 |
| B.堆肥法处理垃圾是最理想的垃圾处理方法 |
| C.废旧金属、玻璃等不属于垃圾 |
| D.没有绝对的垃圾,垃圾也可回收利用 |
节能减排对发展经济、保护环境有重要意义。下列措施不能减少二氧化碳排放的是
| A.利用太阳能制氢 | B.关停小火电企业 |
| C.举行“地球一小时”熄灯活动 | D.推广使用煤液化技术 |
钢铁生锈过程发生如下反应:①2Fe+O2+2H2O=2Fe(OH)2;②4Fe(OH)2+O2+2H2O
=4Fe(OH)3;③2Fe(OH)3=Fe2O3+3H2O。下列说法正确的是
| A.反应①、②中电子转移数目相等 |
| B.反应①中氧化剂是氧气和水 |
| C.与铜质水龙头连接处的钢质水管不易发生腐蚀 |
| D.钢铁在潮湿的空气中不能发生电化学腐蚀 |
钢铁发生吸氧腐蚀时,正极上发生的电极反应为()
| A.2H++2e—→H2↑ | B.Fe2++2e—→Fe |
| C.2H2O+O2+4e—→4OH— | D.Fe3++e—→Fe2+ |