某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):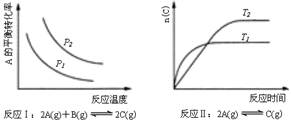
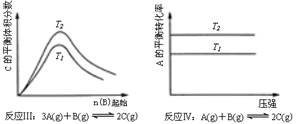
根据以上规律判断,下列结论正确的是( )
| A.反应Ⅰ:△H>0,p2>p1 | B.反应Ⅱ:△H<0,T1>T2 |
| C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1 | D.反应Ⅳ:△H<0,T2>T1 |
下列有关叙述正确的是
| A.非金属氧化物一定为酸性氧化物 |
B.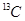 和 和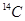 互为同位素,化学性质相似 互为同位素,化学性质相似 |
| C.根据是否能产生丁达尔效应,将分散系分为溶液、浊液和胶体 |
| D.已知红磷比白磷稳定,则4P(红磷,s)=P4(白磷,s)△H<0 |
化学与生产、生活联系密切,下列说法正确的是
| A.常用作净水剂的KAl(SO4)2和漂白粉都是强电解质 |
| B.维生素C具有还原性,在人体内起抗氧化作用 |
| C.对“地沟油”进行分馏可以获得汽油发动机的燃料 |
| D.碘是人体必需的微量元素,所以要多吃富含高碘酸的食物 |
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一。在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学反应方程式(HAc表示醋酸):
请回答下列问题:
(1)C,N,O的第一电离能由大到小的顺序为。
(2)写出基态Cu+的核外电子排布式。
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为。
(4)写出与CO互为等电子体的离子 。(任写一个)
(5)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中 C原子和N原子轨道的杂化类型分别为;1 mol尿素分子中,σ键的数目为 。
T℃时在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是 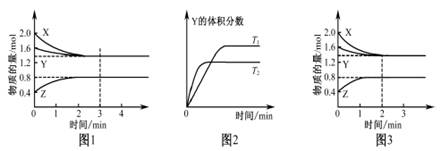
A.反应进行的前3 min内,用X表示的反应速率 |
| B.平衡时容器内的压强为反应前的0.9倍 |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
下列说法或解释不正确的是
A.等物质的量浓度的下列溶液中,
 由大到小的顺序是
由大到小的顺序是
B.室温下,向 溶液中滴加NaOH溶液至中性:
溶液中滴加NaOH溶液至中性: 

在任何温度下都能自发进行