下图为某套实验装置示意图,其中加热装置和部分药品等已经省略(装置①和装置②为气体发生装置)。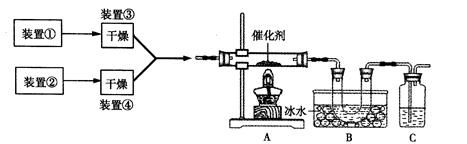
(1)甲同学利用装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验证其性质。装置①用于实验室制备NH3,用装置②制备过量O2。A装置中相应药品在催化加热时发生反应的化学方程式是 。B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,请解释原因 。
(2)乙同学利用此套装置合成SO3,B处冰水冷却的U型管中的固体出现。C中若盛放K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是 (生成物中Cr以Cr3+形式存在);现欲 制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进 (从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明)
制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进 (从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明)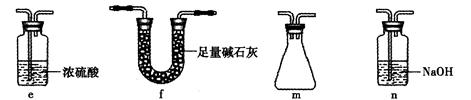
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。
请回答:装置⑦的作用可能是 ;若进入装置⑤的NO共2688mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下2016Mln2,则NO的转化率是
(能正确表达出计算过程即 可)
可)
已知实验室制备1,2-二溴乙烷可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
有关数据列表如下:
| 乙醇 |
1,2-二溴乙烷 |
乙醚 |
|
| 状态 |
无色液体 |
无色液体 |
无色液体 |
| 密度/g · cm-3 |
0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
一l30 |
9 |
-1l6 |
回答下列问题:
(1)反应原理是___________________________________________________________
(2)在装置C中应加入,(填正确选项前的字母)其目的是_______________
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是;
(4)若产物中有少量副产物乙醚.可用的方法除去;
(5)反应过程中应用冷水冷却装置D,其主要目的是;但又不能过度冷却(如用冰水),其原因是。
用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
⑴将准确称取的4.23g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有、。
⑵取10.00mL待测液:用经过(填写操作名称)的碱式滴定管量取至锥形瓶中,并加入2-3滴甲基橙。
⑶用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的,右手不停地向同一方向摇动锥形瓶,两眼注视,直到为止,可判断滴定到达终点。
⑷根据下列数据,烧碱的纯度为。
| 滴定次数 |
待测液体积 (mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
10.00 |
0.50 |
20.40 |
| 第二次 |
10.00 |
4.00 |
24.10 |
⑸判断上述标准酸滴定待测碱的过程中,下列操作引起的误差(填"偏大"、"偏小" "无影响"或"无法判断")
①读数:滴定前平视,滴定后俯视
②未用标准液润洗滴定管
③用待测液润洗锥形瓶
④不小心将标准液滴在锥形瓶外面
⑤滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁
某同学要配制0.2mol/LNa2SO4溶液500mL,请完成下列问题:
(1)需要Na2SO4固体的质量为____________g
(2)配制时,正确的操作顺序是(用字母表示,每个字母只能用一次)______________
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡 |
| B.用托盘天平准确称量Na2SO4固体,在烧杯中用少量水溶解 |
| C.将容量瓶盖紧,振荡,摇匀 |
| D.将已冷却的溶液转移到容量瓶中 |
E.逐滴加水,使溶液凹液面恰好与刻度相切
F.继续向容量瓶内小心加水,直到液面接近刻度2~3cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是____________________________________
某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号)_____,该错误操作会导致测定结果 (填“偏大”、“偏小”或“无影响”)__________________
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影响”)___________________
(3)判断滴定终点的现象是:
(4)图26是某次滴定时的滴定管中的液面,其读数为mL
(5)根据下列数据:请计算待测盐酸溶液的浓度:.
| 滴定次数 |
待测液体积(mL) |
标准烧碱体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.30 |
20.40 |
| 第二次 |
20.00 |
4.00 |
24.20 |
| 第三次 |
20.00 |
2.00 |
24.30 |
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如右下图所示的装置制取乙酸乙酯,请回答下列问题。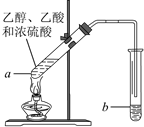
(1)乙醇分子中官能团的名称是__________________。
(2)试管a中加入几块碎瓷片的目的是____________。
(3)试管a中发生反应的化学方程式为________________,反应类型是________________________。
(4)反应开始前,试管b中盛放的溶液是____________。
(5)可用____________的方法把制得的乙酸乙酯分离出来。