(12分)
A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图17 (反应条件和部分产物略去)。试回答:
(1)E的电子式是 。
(2)单质X和B或D均能反应生成黑色固体Y,Y的化学式是 。
(3)物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是 。
(4)取0.3 mol F与足量D充分混合后,所得溶液中再通入0.2 mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+) 。
(5)E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是 。
(已知甲醇的燃烧热 ,氢气的燃烧热
,氢气的燃烧热 )
)
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
(1)工业上二氧化钛的制备是:资料卡片:
物质熔点SiCl4-70 ℃、 TiCl4-25 ℃;物质沸点SiCl457.6 ℃、TiCl4136.5 ℃
Ⅰ.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
Ⅱ.将SiCl4分离,得到纯净的TiCl4。
Ⅲ.在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
Ⅳ.经过滤、水洗除去其中的Cl—,再烘干、焙烧除去水分得到粉体TiO2 。
①在常温下分离TiCl4与SiCl4所采取的操作名称是 ;
;
②Ⅲ中反应的化学方程式是;
③检验TiO2·x H2O中Cl-是否被除净的方法是______________________________。
(2)TiO2粒子的大小可以用现代分析仪器测定,而用氧化还原滴定法可测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。回答下列问题:
①下列可用于测定TiO2粒子大小的方法是_____________________(填字母代号)。
a.核磁共振法 b.红外光谱法 c.质谱法 d.透射电子显微镜法
②配制NH4Fe(SO4)2标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的_____(填字母代号)。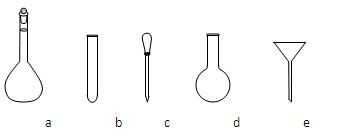
③滴定终点的现象是___________________________________________________。
④滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
⑤若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,对TiO2质量分数测定结果的影响_________________________。(填“偏高”、“偏低”或“无影响”)
Ⅰ、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA的浓度/(mol/L) |
NaOH的浓度/(mol/L) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1)不考虑其它的实验结果,单从甲组情况分析,若a7(填“>”、“<”或“=”)则HA为弱酸;
(2)不考虑其它组的实验结果,仅从乙组情况分析,则下列叙述一定错误的是
| A.酸溶液的物质的量浓度大于碱溶液 |
B.酸溶液中H+的浓度大于碱溶液中O H-的浓度 H-的浓度 |
| C.酸溶液的物质的量浓度小于碱溶液 |
| D.酸溶液中H+的浓度小于碱溶液中OH-的浓度 |
E.两种溶液的物质的量浓度相等
(3)从丙组实验结果分析,HA是酸(填“强”或“弱”)。若此时10mL0.5mol/LNaA溶液与6mL1mol/L盐酸混合后,溶液中除OH—外的各离子浓度由大到小顺序为;
(4)丁组实验所得混合溶液中由水电离出来的c(OH—)=mol/L。
(5)假设HA是一元弱酸,而难溶物CaA2在水中存在溶解平衡:CaA2(s)  Ca2++2A-
Ca2++2A-
△H>0,一定温度下CaA2饱和溶液中Ksp=c(Ca2+)c2(A2-)为一常数。
①温度升高时,Ksp(填“增大”、“减小”或“不变”)。
②测得25℃时,CaA2的Ksp为4.0×10-11,常温下将10g CaA2固体投入100mLCaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1mol/L,则溶液中c(A2-)=。
Ⅱ、平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。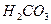

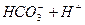
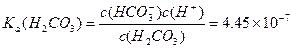
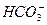


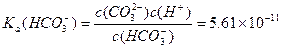
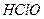

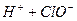
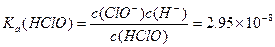
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
(1)将少量的氯气通入到过量的碳酸钠溶液中___ _____________;
(2)氯气和碳酸钠按照1︰1的物质的量之比恰好反应_______________________________;
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
| ⅠA |
0 |
|||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
④ |
||||||
| 3 |
⑤ |
③ |
⑥ |
⑦ |
(1)④、⑥、⑦的离子半径由大到小的顺序为。
(2)1971年美国科学家通过细冰获得含元素④的含氧酸(HXO),在与水反应时,两种分子中的共价键分别断裂成两部分,再重新组合,写出该反应的化学方程式。
(3)①、②两种元素的原子按1:1组成的常见液态化合物的电子式为。在酸性溶液中该物质能将Fe2+氧化,写出该反应的离子方程式。
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气
体,D溶液显碱性。
①写出D溶液与G反应的化学方程式。
②常温下,若电解l L 0.1 mol/L A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为mol。
③若仅电解l L 0.1 mol/L A溶液,图中各步反应均为完全转化,而各物质在反应过程中没有损耗,则混合物X中含有的物质有。
现有一种有机物A,分子式为C4H6O6。对于A的结构与性质实验结论如下:
i:A的分子中有两个羧基;
ii:A的核磁共振氢谱如下图所示;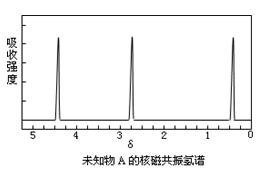
下图是利用烃B和烃I合成有机物A和一种高分子新材料R的转化关系示意图,已知烃I的相对分子质量为28,且F的相对分子质量比E多28。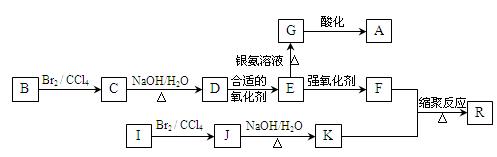
已知: 
②同一个碳原子上连有多个羟基的结构极不稳定,不予考虑。
请分析并按要求回答下列问题:
(1)写出A对应的结构简式:;
(2)写出对应反应的化学方程式:
C→D:;反应类型为:______________________;
E→G:;
F+K→R:;
(3)有机物E的同分异构体M满足下列三个条件:
①1 mol有机物与银氨溶液充分反应生成2 mol Ag
②1 mol有机物与足量NaHCO3溶液反应产生1 mol CO2
③1 mol有机物与足量金属Na反应产生1 mol H2
请判断M的结构可能有种,任写一种M的结构简式。
下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构。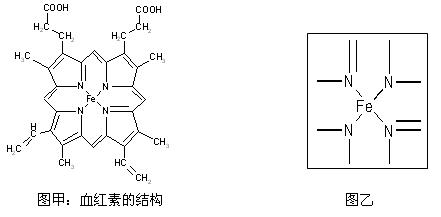
回答下列问题:
(1)血红素中含有C、H、O、N、Fe五种元素,C、H、N、O四种元素的电负性由小到大的顺序是,根据以上电负性请判断H2N-CHO 中C和N的化合价分别为和。写出基态Fe原子的核外价电子排布图。
(2)血红素中两种N原子的杂化方式分别为,在上图乙的方框内用“→”标出Fe2+的配位键。
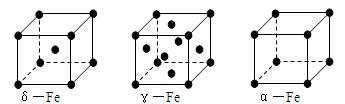
(3)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为,δ、α两种晶胞中铁原子的配位数之比为;在δ晶胞中空间利用率为____________,其晶体的堆积方式的名称为,与其具有相同堆积方式的金属还有(填元素符号)。