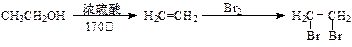已知元素的电负性和原子半径一样,也是元素的一种基本性质,下面给出14种元素的电负性:
| 元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
| 电负性 |
1.61 |
2.04 |
1.57 |
2.55 |
3.16 |
3.98 |
0.98 |
| 元素 |
Mg |
N |
Na |
O |
P |
S |
Si |
| 电负性 |
1.31 |
3.04 |
0.93 |
3.44 |
2.19 |
2.58 |
1.90 |
(1)根据上表给出数据,可推知元素的电负性具有的变化规律是____________________
(2)预测Br与I元素电负性的大小关系是__________________,电负性最小的元素在周期表中的位置是________________________。(放射性元素除外)
(3)离子化合物和共价化合物之间没有绝对的界限,习惯上把SrI2看作离子化合物,把BaS看作共价化合物。(电负性:Sr=0.95;I=2.66;Ba=0.89;S=2.58)我们把两成键原子的电负性差值用△X表示,请找出用△X来判断离子键或共价键的数值范围:
即当△X___________时一般为共价键,当△X___________时一般为离子键。试判断AlBr3中化学键的类型是__________。
根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(1)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式▲;
(2)Be(OH)2与Mg(OH)2可用__▲___试剂鉴别,其反应离子方程式为▲。
(3)Li和Mg根据对角线规则,性质也相似,则Li在空气中燃烧,主要产物的化学式是__▲____;同时还有少量▲生成。
有A、B、C、D四种元素,A元素是地壳中含量最多的金属元素;B元素的原子其M层电子数比L层少1个电子;C元素的原子得到2个电子、D元素的原子失去1个电子所得到的微粒都具有与氖原子相同的电子层结构。回答下列问题:
(1)上述四种元素中C的名称是______▲__________;
(2)画出B元素原子的结构示意图________▲________ ;
(3)写出下列化学方程式:
单质D在单质C中燃烧的化学方程式______▲______ ____ ;
____ ;
A的氢氧化物和D的氢氧化物反应的离子方程式_________▲_______ 。
分子筛可用于物质的分离提纯。某种型号的分子筛的工业生产流程可简单表示如下: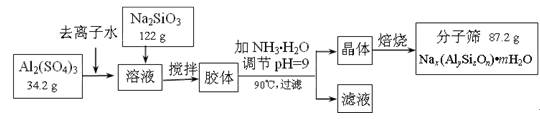
|
 成。已知常温下,Al(OH)3浊液的pH=3,其Ksp=1×10-36,则其中c(Al3+)= ▲ 。
成。已知常温下,Al(OH)3浊液的pH=3,其Ksp=1×10-36,则其中c(Al3+)= ▲ 。
 ▲ (写化学式)。
▲ (写化学式)。
 分子筛。
分子筛。
(12分)
雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得。
(1)元素第一电离能:Al ▲Mg(选填:“>”、“<”、“=”)
(2)雷尼镍催化的一实例为: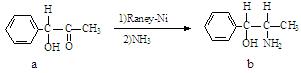
化合物b中进行sp3杂化的原子有: ▲。
(3)一种铝镍合金的结构如下图,与其结构相似的化合物是: ▲(选填序号)。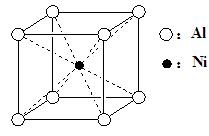
a.氯化钠b.氯化铯c.石英d.金刚石
(4)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀。
①Ni2+在基态时,核外电子排布式为: ▲。
②在配合物中用 化学键和氢键标出未画出的作用力(镍的配位数为4)。
化学键和氢键标出未画出的作用力(镍的配位数为4)。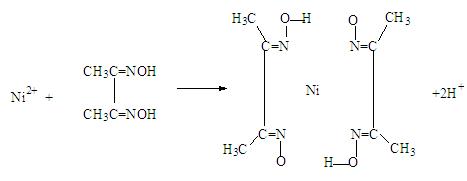
β-拉帕醌(β-lapachone)是一种抗癌新药,合成路线如下: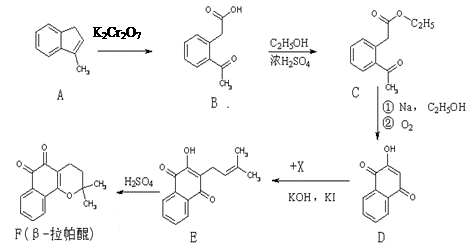
(1)已知X的分子式为C5H9Cl,则X的结构简式为: ▲。
(2)反应类型A→B ▲。
(3)上述反应中,原子利用率达100%的是 ▲(选填:“A→B”、“B→C”、“D→E”、“E→F”)。
(4)D→E发生的是取代反应,还有一种副产物与E互为同分异构体,且属于醚类,该物质的结构简式为: ▲。
(5)化合物B的同分异构体很多,满足下列条件的同分异构体数目有 ▲种(不包括立体异构)。
①属于苯的衍生物②苯环上有两个取代基
③分子中含有一个手性碳原子④分子中有一个醛基和一个羧基
(6)已知:双烯合成反应: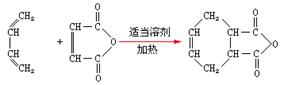 ,试由2-甲基-1,3-丁二烯和乙烯为原料(无机试剂及催化剂任用)合成高分子
,试由2-甲基-1,3-丁二烯和乙烯为原料(无机试剂及催化剂任用)合成高分子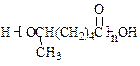 。
。
[提示]合成路线流程图示例如下: