家用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式____________________,已知1mol液态水气化时需要吸收44kJ的热量,则反应 的ΔH为____________________。
的ΔH为____________________。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: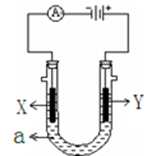
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①在X极附近观察到的实验现象是。
②电解NaCl溶液的离子方程式是。
③将Y电极反应产物通入Na2S溶液中,发生反应的离子方程式为。
(2)若要在铁制品上镀一定厚度的Ag,Y电极反应式为,工作一段时间后pH将___________(填“增大”或 “减小”或“不变”) 。
(3)若X、Y都是铂电极,电解某金属M的氯化物(MCl2)溶液,当收集到1.12 L氯气时(标准状况),阴极增重3.2g,该金属的摩尔质量是______________。
砷(As)广泛分布于自然界,其原子结构示意图是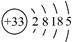 。
。
(1)砷位于元素周期表中族,其气态氢化物的稳定性比NH3 (填“强”或“弱”)。
(2)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据下图写出As2O5分解为As2O3的热化学方程式:。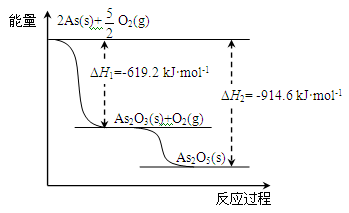
(3)砷酸盐可发生如下反应:AsO43-+2I﹣+2H+ AsO33-+I2+H2O。下图装置中,C1、C2是石墨电极。
AsO33-+I2+H2O。下图装置中,C1、C2是石墨电极。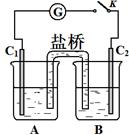
①A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3
的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针
向右偏转。此时C2上发生的电极反应是。
② 一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH
溶液,可观察到电流计指针(填“不动”、“向左偏”或“向右偏”)。
(4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
① 将试样溶于NaOH溶液,得到含AsO43-和AsO33-的混合溶液。As2O5与NaOH溶液反应的离子方程式是。
② 上述混合液用0.02500 mol·L-1的I2溶液滴定,消耗I2溶液20.00 mL。滴定完毕后,使溶液呈酸性,加入过量的KI,析出的I2又用0.1000 mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液30.00 mL。(已知2Na2S2O3+I2=Na2S4O6+2NaI)试样中As2O5的质量是g。
(本题包括2部分,共14分)
Ⅰ.X、Y、Z、W均为短周期元素组成的单质或化合物。在一定条件下有如下转化关系: X+Y→Z+W
(1)若构成X的阴、阳离子个数比为1︰2,且构成X的阴、阳离子中分别含有18个和10个电子,构成Z的阴、阳离子中均含有10个电子。则Z的电子式为。
(2)若X、Y、Z、W四种物质均为分子,且X分子中含18个电子,Y、Z分子中均含有10个电子,单质W分子中含有16个电子。则此化学反应的类型为。
(3)若X、W均为单质,Y、Z均为氧化物且Y、Z中氧的质量分数分别为50%和40%。则该反应的化学方程式为。
(4)若X、Y、Z、W均为非金属氧化物,X的式量比Z的式量小16,Y的式量比W的式量大16,Y是光化学烟雾的主要“元凶”,则该反应的化学方程式为。
Ⅱ.近年来,某些轻元素的含氢化合物及其复合体系作为氢源受到广泛关注。化合物A(XYH2)和B(XH)都是具有潜在应用价值的释氢材料。A受热分解生成固体化合物C并放出刺激性气体D,D可使湿润的pH试纸变蓝;B中X元素的质量分数为87.5%。A和B混合可优化放氢性能。研究发现,该混合体系的放氢反应分三步进行:(1)2A =" C" + D(2)D + B =" A" + H2(3)C + B =" E" + H2
(5)X元素的名称为。
(6)写出A和B混合放氢的化学反应方程式:。
(7)A、C、E均能水解且生成同样的产物,请写出物质C与水反应的化学方程式:。
下表为部分短周期元素化合价及相应氢化物沸点的数据:
| 元素性质 |
元素编号 |
|||||||
| A |
B |
C |
D |
E |
F |
G |
H |
|
| 氢化物的沸点(℃) |
-60.7 |
-33.4 |
-111.5 |
100 |
-87.7 |
19.54 |
-84.9 |
-161.5 |
| 最高化合价 |
+6 |
+5 |
+4 |
+5 |
+7 |
+4 |
||
| 最低化合价 |
-2 |
-3 |
-4 |
-2 |
-3 |
-1 |
-1 |
-4 |
已知:①A与D可形成化合物AD2、AD3,可用于制备强酸甲;
②B与D可形成化合物BD、BD2,可用于制备强酸乙。
请回答:
(1)表中属于第三周期元素的是(用表中元素编号填写)。
写出H的最高价氧化物的结构式:。
(2)比较A、D、G三种简单阴离子的半径大小:r()>r()>r()(均用实际的元素符号表示)。比较元素F、G的氢化物的沸点高低,并说明理由。
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是:。
(5)以下说法正确的是(填编号)。
a.元素H与元素C的单质、其氢化物、最高价氧化物的沸点都是H的高
b.工业上单质C的制备要用到单质H、G;单质C可以与强碱、F的氢化物的水溶液反应
c.能说明元素D的非金属性比A强的实验:把D的单质通入到A的氢化物的水溶液来实现
d.BD2-的钠盐、G-的钠盐的外观及其相似,鉴别它们可以用酸性高锰酸钾溶液、酸性碘化钾淀粉溶液,也可以通过检测两溶液的pH值来鉴别
(12分) 化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
①列式计算实验a从反应开始至达到平衡时的反应速率 v(AX3)=。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由小到大的次序为(填实验序号);
③与实验a相比,其他两组改变的实验条件及判断依据是:
b;
c.。
④用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为 。