酸石粉主要成分为CaCO3。在下图各物质的相互转化中,K、I、J是日常生活中的调味剂,I、J、M、G为有机物,Mr(J)=60,Mr(M)=88,反应①②③均是工业生产中的重要反应。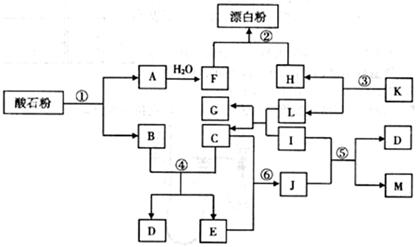
请回答下列问题:
(1)K的化学式: ,J的分子式: 。
(2)反应①中,含10g CaCO3的酸石粉,在 ℃、
℃、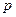 kPa时,完全分解生成A(s)和B(g),吸引a kJ热量(杂质不反应),该反应的热化学方程式为 。
kPa时,完全分解生成A(s)和B(g),吸引a kJ热量(杂质不反应),该反应的热化学方程式为 。
(3)反应④的化学平衡常数的表达式:K= ,已知 则该反应是 反应(填“吸热”或“放热”)。
则该反应是 反应(填“吸热”或“放热”)。
(4)反应⑤的化学方程式为 。
(5)反应⑥生成J,符合绿色化学原则的原因是 。
(15分)钠、铝、铁是三种重要的金属。请回答:
(1)将一小块金属钠投入水中,发生反应的离子方程式为_____________________;可观察到的实验现象是________(填序号)。
a.钠沉到水底b.钠熔成小球 c.小球四处游动 d.溶液变为红色
(2)Fe跟Cl2在一定条件下反应,所得产物的化学式是__________。将该产物溶于水配成溶液,分装在三支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成________色。
b.向另一支试管中滴加NaOH溶液,现象为,
c.向第三只试管中加入铁粉,反生的离子方程式是,
d.Fe跟H2O在一定条件下反应的化学方程式,
(3)Al既能与盐酸反应又能与氢氧化钠反应,请写出与NaOH溶液反应的化学方程式__________________________________________________若反应过程中有1.2mol电子转移,那么消耗NaOH______________mol .
(1)1.204×1024个氯化氢分子的物质的量为________;将其溶于水配成5L溶液,该溶液物质的量浓度为________;
(2)含0.4 mol Al3+的Al2(SO4)3的物质的量是___________,所含的SO42-的物质的量是___________。
硫及其部分化合物的转化关系如图所示。
(1)通常状况下硫单质的颜色为_________。
(2)SO2可以使品红溶液褪色,说明SO2具有_________(填“漂白性”或“氧化性”)。
(3)化合物A的化学式为__________。
(4)反应⑤的离子方程式为___________________________。
(5)反应④中,当32g Cu完全反应时,被还原的H2SO4的物质的量为________mol。
某些铁、铝制品的表面常生成一层氧化物,其主要成分分别是氧化铁、氧化铝。两种氧化物均能与盐酸反应,生成的两种盐的化学式分别为_____________、____________。向这两种盐的溶液中分别滴加足量氢氧化钠溶液,可观察到:其中一种溶液中的现象是先产生白色沉淀,然后白色沉淀逐渐消失则该溶液为_____________溶液;另一种溶液中的现象是______(填序号)。
①产生白色沉淀
②产生红褐色沉淀
③产生白色沉淀,迅速变成灰绿色,最后变成红褐色
印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2,其反应的化学方程式如下:Cu+ 2FeCl3═ CuCl2 + 2FeCl2
(1)指出上述反应中氧化剂是__________,还原剂是__________。
(2)使用过的腐蚀液会失效,但还可以回收利用,其中有一步需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是_______(填序号)。
| A.氯气 | B.铁 | C.盐酸 | D.稀硫酸 |