硫及其部分化合物的转化关系如图所示。
(1)通常状况下硫单质的颜色为_________。
(2)SO2可以使品红溶液褪色,说明SO2具有_________(填“漂白性”或“氧化性”)。
(3)化合物A的化学式为__________。
(4)反应⑤的离子方程式为___________________________。
(5)反应④中,当32g Cu完全反应时,被还原的H2SO4的物质的量为________mol。
(8分)短周期元素X、Y、Z、W在周期表中的位置关系如图所示。已知在同周期元素的常见简单离子中,W的离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。
(1)X元素在元素周期表中的位置是____________________。
(2)X、Y、Z元素的氢化物均有两种或两种以上。
①液态YH3的电离方式与液态H2Z类似,则液态YH3中阴离子的电子式为_____________;
②在一定条件下X2H4与H2Z可发生反应,化学方程式为__________________________,反应类型为_____________________________。
(3)以W为材料制成的容器在空气中具有自我保护作用,这种容器不能贮存强碱溶液,用离子方程式表示其原因为____________________________________________。
(4)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为__________________。
(7分)(1)常温下,已知0.1 mol·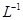 一元酸HA溶液中
一元酸HA溶液中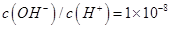 ,则溶液的pH=_____________。
,则溶液的pH=_____________。
①pH=3的HA与pH=l1的NaOH溶液等体积混合;反应的离子方程式为______________;混合溶液中,各离子的物质的量浓度大小关系是____________;
②0.2 mo·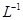 HA溶液与0.1 mol·
HA溶液与0.1 mol·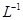 NaOH溶液等体积混合后所得溶液中(溶液体积变化忽略不计):
NaOH溶液等体积混合后所得溶液中(溶液体积变化忽略不计):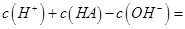 ____________mol·
____________mol·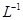 。
。
(2)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=___________。
①该温度下(t℃),将100mL0.1 mol·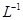 的稀H2SO4与100mL0.4 mol·
的稀H2SO4与100mL0.4 mol·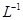 的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=___________;
的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=___________;
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是_______________。
(9分)对合成氨的研究具有很高的应用价值。
在三个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应: ,按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据如下表:
,按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据如下表:
(1)下列能说明该反应已达到平衡状态的是___________(填字母序号)。
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t_________5min(填“>”、“<”或“=”)。
(3)乙中从反应开始到平衡时N2的化学反应速率为__________________。
(4)分析上表数据,下列关系正确的是_________(填字母序号)。
a. mol·
mol· b.
b. c.
c.
(5)该温度下,反应的化学平衡常数K=______________(用分数表示)。
(9分)电化学原理在医学医疗中有重要应用。
(1)碘可用作心脏起搏器电源—锂碘电池的材料。该电池反应如下:
已知:2Li(s)+I2(s)=2LiI(s)△H
4Li(s)+O2(g)=2Li2O(s)△H1
4LiI(s)+O2(g)=2I2(s)+2Li2O(s)△H2
则△H=______________;碘电极作为该电池的_______极。
(2)人工肾脏可采用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],其原理如图所示。
请回答下列问题:
①直流电源的负极为___________(填“A”或“B”);
②阳极室中发生的反应依次为______________________、_______________________;
③电解结束后,阴极室溶液的pH与电解前相比将_____________(填“增大”、“减小”或“不变”);若两极共收集到气体13.44L(标准状况),则除去的尿素为___________g(忽略气体的溶解)。
(8分)短周期元素X、Y、Z、W在周期表中的位置关系如图所示。已知在同周期元素的常见简单离子中,W的离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。
(1)X元素在元素周期表中的位置是___________________。
(2)X、Y、Z元素的氢化物均有两种或两种以上。
①液态YH3的电离方式与液态H2Z类似,则液态YH3中阴离子的电子式为____________________;
②在一定条件下X2H4与H2Z可发生反应,化学方程式为_____________,反应类型为__________。
(3)以W为材料制成的容器在空气中具有自我保护作用,这种容器不能贮存强碱溶液,用离子方程式表示其原因为____________________________________________。
(4)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为___。