已知X、Y、Z、W四种短周期主族元素,原子半径X>Y>Z>W,X、Y、Z处于同一周期,Z、W处于同一主族,X、Y、Z原子序数之和为40,最外层电子数之和为10。据此回答下列有关问题:
⑴X、Y、Z处于____________周期。
⑵若Z原子最外电子数是Y原子最外层电子数的2倍。则元素Y的最高价氧化物对应水化物在水中的电离方程式为_______________;X和W形成的化合物XW2的电子式为________。
⑶若X、W能形成1:1型离子化合物,则其水溶液呈_______性(填“中”、“酸”、“碱”),
并写出电解YZ2溶液的化学方程式___________________________。
美国科学家最近研究发现阿司匹林可降低患哮喘的风险。这项研究成果发表在《美国呼吸系统疾病护理医学杂志》上。阿司匹林(乙酰水杨酸)的合成原理是: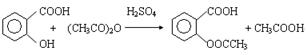
试回答下列问题:
(1)该反应的类型是 。
(2)反应中的4种有机物,遇FeCl3溶液显紫色的是(填名称) 。
(3)1 mol阿司匹林最多可与 mol NaOH溶液反应。
(4)同时符合下列3个条件的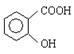 的同分异构体有 种。
的同分异构体有 种。
①遇FeCl3溶液显紫色 ②苯环上含有两个取代基
双氧水(H2O2)是一种极弱电解质,也是一种“绿色氧化剂”。为了贮存、运输的方便,工业上将其转化为固态过碳酸钠(2Na2CO4·3H2O),该物质具有Na2CO3与H2O2的双重性质。请回答下列问题:
(1)写出H2O2的电子式: ,并写出它与SO2反应的化学方程式 。
(2)若把H2O2看成二元弱酸,写出它在水中第一步电离的方程式 。
(3)下列物质不会使过碳酸钠失效的是
| A.MnO2 | B.NaHCO3 | C.H2S | D.CH3COOH |
(4)稀H2SO4不与Cu反应,但在稀H2SO4中加入H2O2后则可使Cu溶解,写出该反应的化学方程式,并用单线桥标明电子转移的方向和数目。
(5)H2O2成为“绿色氧化剂”的理由是 。
由氢气和氧气反应生成1 mol水蒸气放热241.8 kJ,写出该反应的热化学方程式:。若1 g水蒸气转化成液态水放热2.444 kJ,则反应2H2(g)+O2(g) 2H2O(l);ΔH = kJ·mol—1。
2H2O(l);ΔH = kJ·mol—1。
(1)请将下列5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
+ + + + H2O
(2)反应物中发生氧化反应的物质是 ,被还原的元素是 。
(3)反应中1 mol氧化剂 (填“得到”或“失去”) mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中。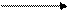

+
氨气与氟气在铜的催化作用下反应得到一种铵盐NH4F和一种含氮化合物A,A的分子结构呈三角锥形,分子中所有共价键之间的夹角都相等。
(1)A的化学式为 ,A的电子式为 。
(2)写出该反应的化学方程式 。
(3)现有1 mol混合气体充分反应后,测得生成物NH4F中的N元素比A中的N元素多2.8 g,试计算原混合气中NH3和F2的物质的量可能各是多少?