[化学一一选修物质结构与性质]
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物其晶胞结构如右图所示。请回答下列问题。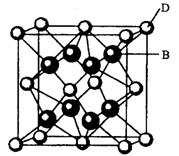
(1)E元素原子基态时的电子排布式为 ;
(2)A2F分子中F原子的杂化类型是 ,F的氧化物FO3分子空间构型为 ;
(3)CA3极易溶于水,其原因主要是  ,试判断CA3溶于水后,形成CA3·H2O的合理结构 (填字母代号),推理依据是:
,试判断CA3溶于水后,形成CA3·H2O的合理结构 (填字母代号),推理依据是:
。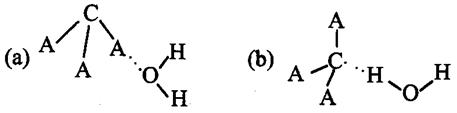
(4)从图中可以看出,D跟B形成的离子化合物的化学式为 ;该离子化合物晶体的密度为ag·cm-3。,则晶胞的体积是 (写出表达式即可)。
医药化学杂志报道,用聚乙交酯纤维材料C制作的缝合线比天然高分子材料的肠衣线的性能好.它的合成过程如下:
(1)写出A的结构简式______________________________________________.
(2)写出A制取B的化学方程式_______________________________________.
(3)可以由A直接制备C,则由A直接制备C的化学方程式为_____________.其反应类型为________________.
高分子化合物A和B的部分结构如下: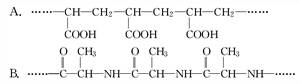
(1)合成高分子化合物A的单体是________,生成A的反应是________反应.
(2)合成高分子化合物B的单体是________,生成B的反应是________反应.
完成下列反应的化学方程式,并指出反应类型.
(1)由乙烯制取聚乙烯:
________________________________________________________________________,
(2)由丙烯制取聚丙烯:
________________________________________________________________________,
(3)由对苯二甲酸(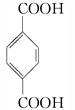 )与乙二醇发生反应生成高分子化合物:
)与乙二醇发生反应生成高分子化合物:
______________________________________,________________________.
聚苯乙烯的结构为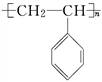 ,试回答下列问题:
,试回答下列问题:
(1)聚苯乙烯的链节是________________________,单体是______________________.
(2)实验测得某聚苯乙烯的相对分子质量(平均值)为52000,则该高聚物的聚合度n为________________.
含有氨基(—NH2)的化合物通常能够与盐酸反应,生成盐酸盐,如:R—NH2+HCl―→R—NH2·HCl(R代表烷基、苯基等).
现有两种化合物A和B,它们互为同分异构体.已知:
①它们都是对位二取代苯;
②它们的相对分子质量都是137;
③A既能被NaOH溶液中和,又可以跟盐酸成盐,但不能与FeCl3溶液发生显色反应;B既不能被NaOH溶液中和,也不能跟盐酸成盐;
④它们的组成元素只可能是C、H、O、N、Cl中的几种.
请按要求填空:
(1)A和B的分子式是________.
(2)A的结构简式是______________________;
B的结构简式是______________________.