已知:2SO3 2SO2+O2,在起始时体积相同的容器A和B中,同时分别充入2molSO3(两容器装有催化剂)。在反应过程中,A保持温度和容积不变;B保持温度和压强不变。回答下列问题:
2SO2+O2,在起始时体积相同的容器A和B中,同时分别充入2molSO3(两容器装有催化剂)。在反应过程中,A保持温度和容积不变;B保持温度和压强不变。回答下列问题:
(1)反应达平衡所需时间A B(大于;等于;小于);达平衡时SO3的转化率
A B(大于;等于;小于)。
(2)若平衡后,向A、B中分别充入惰性气体, 容器的平衡将向 方向移动;若平衡后,向A、B中分别充入等物质的量SO3,重新达平衡时,两容器中的SO3转化率变化情况是(填变大、变小、不变)A ,B
【改编】(17分)合成氨技术的发明使工业化人工固氮成为现实。
(1)已知N2(g)+3H2(g) 2NH3(g)
2NH3(g) H=-92.2kJ·mol-1。在一定条件下反应时,当电子转移3mol时,放出的热量为 。
H=-92.2kJ·mol-1。在一定条件下反应时,当电子转移3mol时,放出的热量为 。
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如下图所示。由图可知:
①温度T1、T2时的平衡常数分别为K1、K2,则K1 K2(填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,氮气的平衡转化率 (填“增大”、“减小”或“不变”)。
②T2温度时,在1L的密闭容器中加入2.1mol N2、l.5molH2,经10min达到平衡,则v(NH3)= 。达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则V正 V逆(填“>”或“<”或“=”)。
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g) H2O(1)+CO(NH2)2(1)△H,在一定压强下测得如下数据:
H2O(1)+CO(NH2)2(1)△H,在一定压强下测得如下数据:
①该反应破坏旧化学键吸收的能量 形成新化学键放出的能量,表中数据a d,b f(均选填“>”、“=”或“<”)。
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理 。
已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
Ⅰ.若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O 乙+丙
乙+丙
b.乙 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则甲发生a反应的化学方程式为: ;
②若甲为某短周期金属元素的氯化物,则该金属在周期表中的位置是: ;
若向30 mL 1 mol/L的甲的溶液中逐渐加入浓度为4 mol/L的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为 (选填编号).
| A.3 mL | B.7.5 mL | C.15 mL | D.27.5 mL |
③将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则负极发生的电极反应为 。
Ⅱ.若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙 丙。则:
丙。则:
①写出上述反应的化学方程式 。
②0.5 mol气体甲与足量的过氧化钠反应,转移电子的数目为 。
③将一定量气体甲通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(甲)的关系如图所示,溶液A中各离子浓度由大到小的顺序为 。
【改编】【物质结构与性质】一定条件下,Ni2+与丁二酮肟生成鲜红色沉淀A。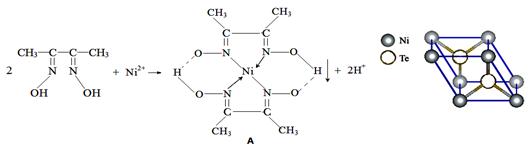
(1)基态Ni2+核外电子排布式为 。
(2)丁二酮肟组成元素中C、N、O的第一电离能由小到大的顺序为 、电负性由大到小的顺序为 。丁二酮肟分子中C原子轨道的杂化类型是 、N原子轨道的杂化类型是 。
(3)元素Ni的一种碲(Te)化物晶体的晶胞结构如图所示,则该化合物的化学式为 。
(4)Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为-19.3℃。Ni(CO)4晶体熔化时克服的作用是 。请写出一种由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式 。
【化学与技术】合成氨工业对国民经济和社会发展具有重要意义,下图是工业合成氨的简要流程示意图。
(1)合成氨的原料气往往混有CO2等杂质,在进入合成塔之前需净化,其原因是_______ 。
(2)工业上合成氨选择的适宜条件是:以铁为主的催化剂、_______、________。
(3)沿X路线进入合成塔的物质是_______,这样设计的意义是________。
(4)目前工业制硝酸所采用的主要方法是_______法。
【改编】下图是某研究性学习小组设计的对一种废旧合金的各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。
已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mn(OH)2] =1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ需要的玻璃仪器有 。
(2)加入过量FeCl3溶液过程中可能涉及的离子方程式: 。
(3)过量的还原剂应是 。
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为 。
②若用X mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液YmL,则最后所得沉淀M的质量为 g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为: ﹥ ﹥ 。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Z g,同时测得阴阳两极收集到的气体体积相等,则混合气体的成分是 ,标况下阳极生成的最后一种气体体积为 L(用含Z的代数式表示)。