海水资源的利用具有广阔前景。海水中主要离子的含量如下:
| 成分 |
含量/(mg L-1) |
成分 |
含量/(mg L-1) |
| Cl- |
18980 |
Ca2+ |
400 |
| Na+ |
10560 |
HCO3- |
142 |
| SO42 |
2560 |
Br- |
64 |
| Mg2+ |
1272 |
|
|
电渗析法淡化海水示意图如图所示,其中阴(阳)
离子交换膜仅允许阴(阳)离子通过。
①阳极主要电极反应式是 。
②在阴极附近产生少量白色沉淀,其成分有 和CaCO3,
生成CaCO3的离子方程式是 。
③淡水的出口为 (填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下: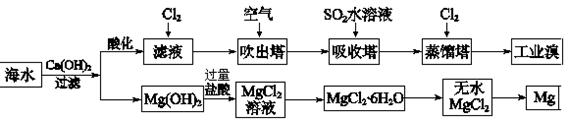
①提取溴的过程中,经过2次Br-→Br2转化的目的是 ,吸收塔中发生反应的离子方程式是 。解释通空气的目的是 。
②从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是 、过滤、洗涤、干燥。
③依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为
L(忽略Cl2溶解,溴的相对原子质量:80)。
汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g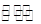 2NO(g)ΔH>0,已知该反应在2 404 ℃时,平衡常数K=64×10-4。
2NO(g)ΔH>0,已知该反应在2 404 ℃时,平衡常数K=64×10-4。
请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率________。
(2)假设该反应是在恒容条件下进行,判断该反应达到平衡的标志________。
| A.消耗1 mol N2同时生成1 mol O2 |
| B.混合气体密度不变 |
| C.混合气体平均相对分子质量不变 |
| D.2v(N2)正=v(NO)逆 |
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是________(填字母序号)。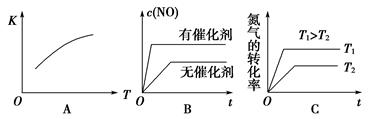
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数______。(填“变大”、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2mol/L和3.0×10-3 mol/L,此时反应________________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是__________________________________________________________。
(20分)物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡:
(1)有0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为。
(2)有0.1 mol·L-1的NaHCO3溶液,在该溶液中存在的平衡有三个,请分别用离子方程式表示:
____________________、__________________________、。
(3)已知25℃时Ksp[Mg(OH)2]=1.2×10-11,KsP[Cu(OH)2]=2.2×10-20。在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,则最先生成的沉淀的离子方程式为
。
(4)NH3·H2O 的电离方程式是,往氨水中加入少量醋酸铵固体(提示醋酸铵呈中性),C(OH-)(填“增大”“减小”“不变”)。
(5)已知某温度下K(NH3·H2O)=1.69×10-5,
则该温度下0.1mol/L的氨水中C(OH-)= mol/L
(6)又已知该温度下Ksp〔Mg(OH)2〕=1.2×10-11,
将0.01mol/L的MgCl2溶液与上述氨水等体积混合(填“有”“无”)沉淀生成。往0.01mol/L的MgCl2溶液中滴加氢氧化钠溶液至pH="10" 此时C(Mg2+)=mol/L。
A、B、C、D、E五种物质都含钠元素,它们按图所示关系相互转化,已知A 为单质。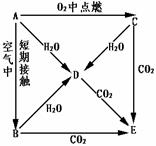
(1)该五种物质中用于焙制糕点的发酵粉及治疗胃酸过多的药品是(填化学式)。
(2)将CO2通入E的饱和溶液中有白色沉淀生成,该反应的离子方程式为。
(3)写出A→D、C→D、C→E反应的化学方程式
A→D:
C→D:
C→E:
下图表示的是向Na2CO3溶液中滴入稀盐酸(单位为ml)时产生CO2的过程。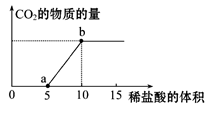
(1)写出a点以前发生反应的离子方程式:
(2)写出a到b点发生反应的离子方程式:
(3)若某Na2CO3溶液中含84.8g Na2CO3,向其中滴入一定量的稀盐酸,恰好使溶液中Cl-和HCO3-的物质的量之比为2∶1,则滴入的稀盐酸中的HCl的物质的量为mol(保留小数点后两位数字)。
(4)已知HCO3-+OH-=== CO32-+H2O ,若某溶液中含1 mol NaHCO3,滴入一定量的稀NaOH,恰好使溶液中Na+ 和HCO3-的物质的量之比为2:1,则滴入的NaOH的物质的量为mol。
已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下
3Cu + 8HNO3 ="=" 3Cu(NO3)2 + 2NO↑+ 4H2O
(1)上述反应中氧化剂与氧化产物的物质的量之比。
(2)若生成NO的体积为3.36L(标准状况),且硝酸足量,则消耗铜的质量g,转移电子的数目为,被还原的硝酸为mol。
(3)写出该反应的离子方程式。