汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g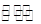 2NO(g)ΔH>0,已知该反应在2 404 ℃时,平衡常数K=64×10-4。
2NO(g)ΔH>0,已知该反应在2 404 ℃时,平衡常数K=64×10-4。
请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率________。
(2)假设该反应是在恒容条件下进行,判断该反应达到平衡的标志________。
| A.消耗1 mol N2同时生成1 mol O2 |
| B.混合气体密度不变 |
| C.混合气体平均相对分子质量不变 |
| D.2v(N2)正=v(NO)逆 |
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是________(填字母序号)。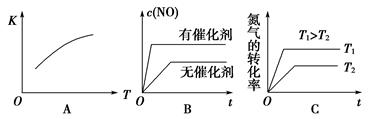
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数______。(填“变大”、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2mol/L和3.0×10-3 mol/L,此时反应________________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是__________________________________________________________。
今有下列两组单质,试将每组单质从不同角度进行“分类”,每种“分类”都可分别挑出一种单质,它跟其他三种单质属于不同的“类”,将挑出的单质(写化学符号)和挑选依据(写编码)列在下面相应的表格内:
两组单质为:Ⅰ.O2、F2、S、N2Ⅱ.Fe、Na、Al、Si
“挑选依据”仅限于下述六种。该被挑出的单质跟其他三种单质不同,是由于:
| A.其组成元素不属于金属(或非金属); | B.其组成元素不属于周期表中的同一族; | C.其组成元素不属于周期表中的同一周期; | D.其组成元素不属于主族(或副族)元素;(E)在常温常压下呈不同物态;(F)在常温下遇水能(或不能)迅速产生气体。 |
| 答案1 |
答案2 |
答案3 |
答案4 |
答案5 |
答案6 |
|
| 单质 |
Si |
|||||
| 挑选依据 |
A |
向体积为10 L的固定密闭容器中通入3 mol X气体,在一定温度下发生如下反应:2X(g) Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min后反应达到平衡Ⅰ,此时测得容器内的压强为起始时的1.2倍,则且Y表示的反应速率为 mol/(L·min);
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内反应速率分别为 :甲:
:甲: 丙:
丙: 。若其它条件下同,温度不同,则温度由高到低的顺序是(填序号) ;
。若其它条件下同,温度不同,则温度由高到低的顺序是(填序号) ;
(3)若向Ⅰ的平衡体系中充入氮气,则平衡 (填“向左”或“向右”或“不”)移动;若将Ⅰ的平衡体系中部分混合气体移走,则平衡 (填“向左”或“向右”或“不”)移动;
(4)若在相同条件下向Ⅰ的平衡体系中再充入0.5 mol X气体,则原平衡Ⅰ中X的转化率与重新平衡后X的转化率相比较 (选填字母)。
| A.无法确定 | B.前者一定大于后者 |
| C.前者一定等于后者 | D.前者一定小于后者 |
(5)若保持温度不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol,达到平衡时各气体体积分数与Ⅰ平衡相同,且起始时维持化学反应向逆反应方向进行。则c的取值范围应该为 。
Ⅰ.现有四种有机化合物:
试回答:
(1)甲、乙、丁都含有的官能团名称是 ;
(2)1 mol甲、乙、丁分别与足量Na反应,生成H2最多的是 (填编号,下同);
(3)互为同分异构体的是 ;
(4)等物质的量的甲、乙、丁充分燃烧,消耗氧最少的是 ;
(5)丁与醋酸在催化下发生取代反应生成的酯有 种。
Ⅱ.白乳胶是一种在日常生活中使用广泛的有机物。某校化学兴趣小组拟用下列合成路线合成该物质: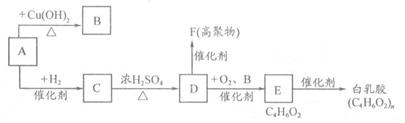
试回答:
(1)A的结构简式为 ;
(2)写化学方程式:
A→B ;
D→E 。
A、B、C、D、E、X、Y为中学常见的七种物质,它们有如下转化关系(部分产物与反应条件略去):
(1)若A为金属单质,B为氢气,X为盐酸,Y为强碱溶。则A物质的名称是 ;D与Y反应的离子方程式为 ;
(2)若A、C为同主族元素组成的单质,通常状况下,A为气体,C为液体,Y为金属单质。则A→C的反应类型是 ;E溶液中滴入NaOH溶液的实验现象为 ;
(3)若A、D为同一物质,常温下A、X为气体化合物且X有臭鸡蛋气味,C为固体单质。则A、D的化学式均为 ;将X通入A的溶液中,可观察到的现象是 ;D→E的化学反应方程式为 。
常温下,浓度均为0.1 mol/L的四种溶液:
①Na2CO3溶液 NaHCO3溶液③盐酸④氨水
试回答下列问题:
(1)上述溶液中有水解反应发生的是 (填编号,下同),溶液中溶质存在电离平衡的是 ;
(2)比较①、②溶液,PH值较大的是 ;
(3)在溶液④中加入少量NH4Cl固体,此时 的值将 (填“变小”,“变大”或“不变”);
的值将 (填“变小”,“变大”或“不变”);
(4)用溶液③滴定V mL溶液④,其滴定曲线如右图所示:
①试分析在滴定过程中,滴定曲线上a、b、c、d四点:水的电离程度最大的是 点,理由是; ;
②a点溶液中离子浓度大小关系是 ;
③取少量c点溶液于试管,再滴加0.1 mol/L NaOH溶液至中性。此时溶液中除H+、OH-外, 离子浓度大小关系是 。
离子浓度大小关系是 。