某种芳香族化合物A由碳、氢、氧三种元素组成,经测定碳、氢的质量分数分别为73.2%和7.32%。
(1)A的分子式是 。
(2)已知:
ⅰ.  (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
ⅱ. 
又知,A在一定条件下能发生如下转化,某些生成物(如H2O等)已略去。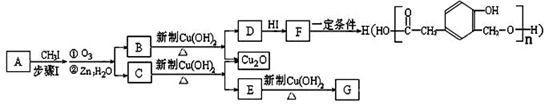 请回答:
请回答:
①步骤Ⅰ的目的是 ;
②若G的相对分子质量是44,则E的结构简式是 ;
③ F→H的反应类型是 ;
④ F在一定条件下可发生分子内酯化反应,生成含七元环结构的M。请写出该反应的化学方程式 ;
⑤A的结构简式是 ;
上述转化中B→D的化学方程式是 。
(3)已知A的某种同分异构体N具有如下性质:
①N与FeCl3反应,溶液呈紫色;
②N在一定条件下可发生银镜反应,N与H2在苯环侧链上按照物质的量之比1:1作用后的生成物不能发生消去反应;
③在通常情况下,1molN最多能与1molBr2(浓溴水)发生取代反应;
④N分子中苯环上的取代基上无支链且只有三个支链;
N可能的结构有______种,请写出其中一种的结构简式 。
完成下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:_____。
(2)周期表中位于第8纵行的铁元素属于第_____族。
(3)周期表中最活泼的非金属元素位于第纵_____行。
(4)所含元素超过18种的周期是第_____、_____周期。
A、B、C为短周期元素,在周期表中所处位置如右图所示,A、C两种元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。
(1)写出A、B、C三种元素的名称:_____、_____、_____。
(2)B位于元素周期表中第_____周期,第_____族。
(3)C的原子结构示意图为_____,C的单质与水反应的化学方程式为_______________。
(4)比较B、C的原子半径_____,写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式____________________。
某元素R有4个电子层,最外层上有5个电子,指出:
(1)R在第_____周期,第_____族,元素符号_____。
(2)R的最高正价_____,负价_____,最高价氧化物化学式_____,对应水化物化学式_____,氢化物化学式_____。
实验室为验证同主族元素性质递变规律,准备了如下药品:
①AgNO3(aq)②稀HNO3③Br2(aq)④I2(aq)⑤NaOH(aq)⑥NaCl(aq)⑦NaBr(aq)⑧H2O⑨Na⑩镁条⑪铝条⑫K
(1)你准备选用的药品是(用编号表示)______。
(2)你所做的实验是什么(用方程式表示)?判断依据是什么?
X、Y、Q、R是同一短周期的元素。已知:
(1)X的最高正价绝对值是最低负价绝对值的3倍,其气态氢化物与最高价氧化物的相对分子质量之比是1∶2.35。
(2)Y和Q的气态氢化物分子组成分别是YH4和QH3。R的氢化物化学式为RH2,但常温时不是气态的。
(3)另有一种元素E,其阳离子和X的阴离子带有等量的相反电荷,且核外电子数相同。请指出X、Y、Q、R、E各是什么元素以及它们在元素周期表中的位置。