J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最高正化合价与最低负化合价的绝对值相等;M是地壳中含量仅次于氧元素的非金属元素;L的最简单气态氢化物甲能使湿润的红色石蕊试纸变蓝。
(1)M的原子结构示意图为________ ;元素R在周期表中位于第_____周期,第_____族, 元素T最高价氧化物对应水化物化学式是________。
(2)写出J和氧形成的一种酸性氧化物的电子式____________,含有共价键是______(填极性键或非极性键)。
(3)写出能说明T非金属性比R强的反应的化学方程式___________________________
(4)在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______________________________________
(5)0.2mol由M形成的气态氢化物在O2中完全燃烧,生成一种固体和液态水,298K时放出热量a kJ 。 该反应的热化学方程式为_____________________________________________
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下: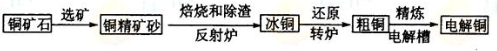
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应
生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。该过程中两个主
要反应的化学方程式分别是 、 ,反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%--50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O,生成Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是 、 ;
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板应是图中电极_ _(填图中的字母);在电极d上发生的电极反应式为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。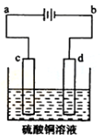
化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行10min,溶液的pH由7变为12。
①N2的结构式为 。
②上述反应的离子方程式为 ,其平均反应速率υ(NO3-)为 mol·L-1min-1。
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法 。
(2)电化学降解NO3-的原理如图所示。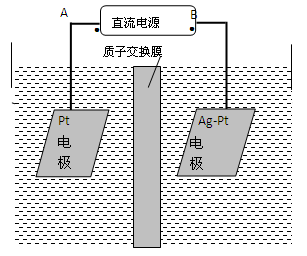
①电源正极为 (填A或B),阴极反应式为 。
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为 g。
NH3经一系列反应可以得到HNO3,如下图所示。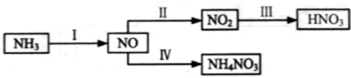
(1)I中,NH3和O2在催化剂作用下反应,其化学方程式是_____________________。
(2)II中,2NO(g)+O2 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。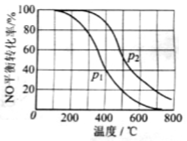
①比较P1、P2的大小关系:________________。
②随温度升高,该反应平衡常数变化的趋势是________________。
(3)III中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g) N2O4(g)△H1
N2O4(g)△H1
2NO2(g) N2O4(l)△H2
N2O4(l)△H2
下列能量变化示意图中,正确的是(选填字母)_______________。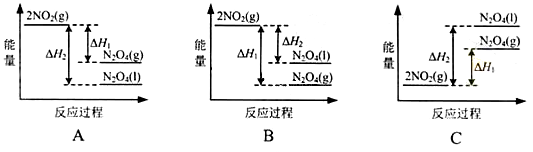
②N2O4与O2、H2O化合的化学方程式是_________________。
(4)IV中,电解NO制备 NH4NO3,其工作原理如右图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_____________,说明理由:________________。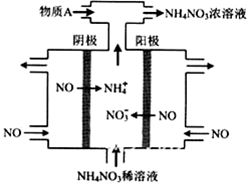
硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。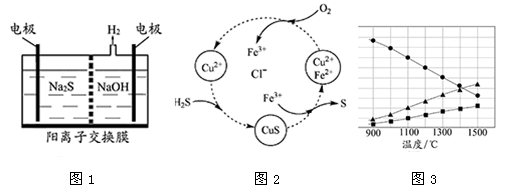
(1)将烧碱吸收H2S后的溶液加入到如图1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2-—2e- S(n—1)S+ S2-
S(n—1)S+ S2- Sn2-
Sn2-
①写出电解时阴极的电极反应式: 。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成 。
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示。
①在图示的转化中,化合价不变的元素是 。
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为 。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有 。
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图3所示,H2S在高温下分解反应的化学方程式为 。
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlC13(g)+3C(s) =3AlCl(g)+3CO(g)△H="a" kJ·mol-1
3AlCl(g)=2Al(l)+AlC13(g)△H="b" kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b的代数式表示)。
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为 。
(2)镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al122+17H2=17MgH2+12Al。得到的混合物Y(17MgH2 +12Al)在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是 。
②在6. 0 mol·L-1 HCl 溶液中,混合物Y能完全释放出H2。1 mol Mg17 Al12完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2的物质的量为 。
③在0. 5 mol·L-1 NaOH 和1. 0 mol·L-1 MgCl2溶液中,混合物Y均只能部分放出氢气,反应后残留固体物质的X-射线衍射谱图如图所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH 溶液中,混合物Y 中产生氢气的主要物质是 (填化学式)。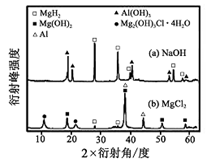
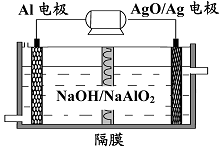
(3)铝电池性能优越,Al-AgO 电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为 。