Ⅰ.向FeCl3溶液中加入铁粉和铜粉混合粉末,充分反应后,下列情况可能存在的是 (填序号)
| 序号 |
溶液中的盐 |
固体不溶物的成分 |
| ① |
FeCl3、CuCl2 |
Fe、Cu |
| ② |
FeCl2、CuCl2 |
Cu |
| ③ |
FeCl2 |
Cu |
| ④ |
FeCl3、CuCl2 |
Cu |
| ⑤ |
FeCl2、CuCl2 |
Fe |
| ⑥ |
FeCl2、CuCl2、FeCl3 |
没有固体不溶物 |
| ⑦ |
FeCl2 |
Fe、Cu |
Ⅱ.今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4mol/L的FeCl3,溶液(其他用品略),某课外活动小组同学的实验结果如下(假定反应前后溶液体积不变)。
| 组别 |
① |
② |
③ |
④ |
| 混合粉末质量/g |
40 |
40 |
40 |
40 |
| V[FeCl3(aq)]/mL |
150 |
300 |
330 |
350 |
| 反应后剩余固体质量/g |
23.2 |
6.4 |
2.56 |
x |
(1)试判断第④组剩余固体质量x为 。第①组实验中,发生反应的离子方程式为 。
(2)试判断第②组剩余固体的成分为 。
(3)原混合粉末中Fe、Cu的物质的量之比为 。
“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
请回答下列问题:
(1)工艺操作①、②分别为__________、__________。
(2)写出生成“产品”的离子方程式_________________________________。
(3)检验合成氨厂废气中含有氨气的方法是___________________________
___________________________________________________________。
(4)副产品的化学式为__________,该联合生产工艺中可循环使用的物质是
________。
下图表示的是侯氏制碱法工艺流程示意图。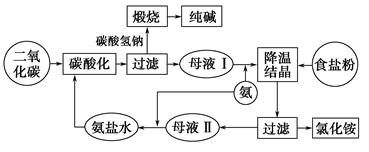
请回答:
(1)母液Ⅱ中所溶解的主要物质是________(写物质的化学式)。母液Ⅱ中含有低浓度的Na2CO3,主要原因是__________________________
(2)向母液Ⅱ中通入气体时要先通氨气后通二氧化碳气体,主要原因是_______________________________________
(3)母液Ⅰ和母液Ⅱ中都通入NH3。①NH3的主要来源是__________;②母液Ⅰ中通入NH3的主要目的是____________;③母液Ⅱ中通入NH3的主要目的是__________________。
(4)工艺流程的“煅烧→纯碱”处,可设计____________的循环。
侯氏制碱法的步骤如下图: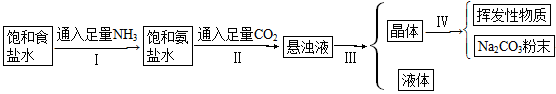
试回答下列问题:
(1)若上述的悬浊液是NaHCO3和NH4Cl的混合液,则Ⅰ和Ⅱ的总反应为
_______________________________________________
(2)由这一反应可知NaCl比NaHCO3溶解度______________________。
(3)Ⅲ的操作叫____________。
(4)Ⅳ的操作叫____________。
工业生产纯碱的工艺流程示意图如下: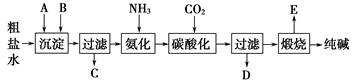
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A______________ B____________。
(2)实验室提纯粗盐的实验操作依次为:
取样、__________、沉淀、__________、__________、冷却结晶、__________、烘干。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是__________________。
碳酸化时没有析出碳酸钠晶体,其原因是______________________.
(4)碳酸化后过滤,滤液D最主要的成分是______________(填写化学式),检验这一成分的阴离子的具体方法是:______________________。
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为:____________________________。
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:__________(注明你的表达式中所用的有关符号的含义)。
纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:___________________________。
(2)写出“联合制碱法”有关反应的化学方程式:_______________________
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?_______________________。
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应列出计算原子利用率的表达式:原子利用率(%)=_________________。