电解原理常应用于工业生产
(1)火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电解精炼时,若用硫酸铜溶液作电解液,粗铜接电源 极,电极反应为 ;通电一段时间后,溶液中铜离子浓度将 (增大,不变,减少)。
(2)工业上用电解饱和食盐水的方法可制得烧碱、氯气、氢气。电解时,总离子反应
式为 ;电解时所需的精制食盐水,通常在粗盐水
加入某些试剂(现提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液来、BaCl2
溶液、Ba(NO3)2溶液、盐酸)除去其中的Ca2+、Mg2+、Fe3+、SO42-杂质离子,选出试剂,
按滴加的先后顺序为 (填所加试剂的化学式)。
(3)为了避免产物相混合发生副反应,工业上采用离子交换膜法电解食盐水。下图为阳离
子交换膜法电解饱和食盐水原理示意图。
|
下列说法中正确的是
| A.从E口逸出的气体是H2 |
| B.从B中加入含少量NaOH的水溶液以增强导电性 |
| C.标准状况下每生成22.4L Cl2,便产生2mol NaOH |
| D.向电解后的阴极溶液中加适量盐酸,可以 |
恢复到电解前的物质的浓度
(6分)
某烯烃,经与氢气加成反应可得到结构简式为 的烷烃,则此烯烃可能的结构简式是: 、 、 。
的烷烃,则此烯烃可能的结构简式是: 、 、 。
写出下列化合物的名称或结构简式:
(1)结构简式为 此烃名称为 。
此烃名称为 。
(2)结构简式为 的烃可命名为 。
的烃可命名为 。
(3)2,5-二甲基-2,4-己二烯 的结构简式: 。
(4)结构简式为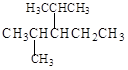 的烃可命名为: 。
的烃可命名为: 。
(4分)有下列几组物质,请将序号填入下列空格内:
| A.CH2=CH-COOH和油酸(C17H33COOH) |
| B.C60和石墨 |
C. 和 和 |
| D.35Cl和37Cl |
E.乙醇和乙二醇
①互为同位素的是 ;②互为同系物的是 ;
③互为同素异形体的是 ;④互为同分异构体的是 ;
I.还原剂还原法、光催化氧化法、电化学吸收法是减少氮氧化物排放的有效措施。
(1)利用炭粉可以将氮氧化物还原。
已知:N2(g)+O2(g)=2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
反应:C(s)+2NO(g)=CO2(g)+N2(g)ΔH=_____kJ·mol-1。
(2)TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,OH能将NO、NO2氧化,如下图所示,OH与NO2的反应为NO2+OH=HNO3。
写出OH与NO反应的化学方程式:_____________。
II.甲醇、乙醇是重要的有机化工原料,有着重要的用途和应用前景。
(3)若在恒温恒容的容器内进行反应CO(g)+2H2(g) CH3OH(g),则可用来判断该反应达到平衡状态的标志有(填字母)。
CH3OH(g),则可用来判断该反应达到平衡状态的标志有(填字母)。
| A.H2百分含量保持不变 |
| B.容器中气体的压强保持不变 |
| C.容器中混合气体的密度保持不变 |
| D.2v(H2)正= v(CH3OH )逆 |
(4)CO(g)+2H2(g) CH3OH(g) 其平衡常数表达式为K=___________。该反应的平衡常数K 随温度T 的变化如图所示,
CH3OH(g) 其平衡常数表达式为K=___________。该反应的平衡常数K 随温度T 的变化如图所示,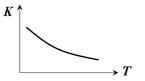
则该反应的 △H0。(填“>”、“<”或“=”)。已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
(5)下图所示是一种酸性燃料电池乙醇检测仪,具有自动吹气流量侦测与控制的功能,适合进行现场乙醇检测。负极反应式为_________。
在精制饱和食盐水中加入碳酸氢铵,可制取小苏打(NaHCO3)并提取氯化铵作为肥料或进一步提纯为工业氯化铵。完成下列填空:
(1)写出上述制备小苏打的化学方程式
(2)滤出小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤
②不通氨,冷却、加食盐,过滤
对两种方法的评价正确的是(选填编号)
a.①析出的氯化铵纯度更高 b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用 d.②的滤液可直接循环使用
(3)提取的NH4Cl中含少量Fe2+、SO42-。将产品溶解,加入H2O2,一段时间后将溶液加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。
加热至沸的目的是________________;滤渣的主要成分是_________________。
(4)称取1.840g小苏打样品(含少量NaCl),配成250ml溶液,取出25.00ml用0.1000mol/L盐酸滴定,消耗盐酸21.50ml。选甲基橙而不选酚酞作为指示剂的原因是__________。
(5)将一定质量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果_______。(选填“偏高”、“偏低”或“无影响”)