氯碱工业中电解饱和食盐水的原理示意图如下图所示: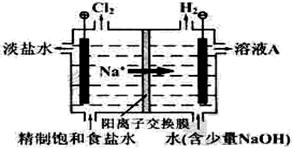
(1)溶液A的溶质是 (写化学式);电解饱和食盐水的离子方程式是 ;
(2)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 ;
(3)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42->c(Ca2+)]。
精制流程如下(淡盐水和溶液A来自电解池):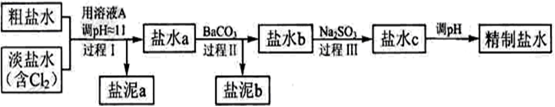
①盐泥a除泥沙外,还含有的物质是 。
②过程Ⅰ中将NH4+转化为N2的离子方程式是
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有
(6分)在由铜片、锌片和150 mL稀硫酸组成的原电池中,当在铜片上放出6.72 L(标准状况)的H2时,硫酸恰好用完,则:
(1) 产生这些气体消耗的锌的质量是g;
(2) 通过导线的电子的物质的量是mol;
(3) 该原电池正极的电极反应式为。
(3分) +2价金属元素M的原子中质子数比中子数少2个,2.1g的单质M与足量的盐酸反应共产生氢气0.05mol。试通过计算确定:
(1)该元素的摩尔质量为g/mol,
(2)用 形式表示上题中金属元素M的原子。
形式表示上题中金属元素M的原子。
下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固 氮反应。
氮反应。
请回答下列问题:
(1)用化学式表示下列物质
A C E G  J
J
(2)写出下列物质间反应的化学方程式
A和B :
:
F和CO2:
D和E:
(3)写出G和I反应的离子方程式:。
有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)D元素位于周期表中周期族。
(2)写出C2B的水化物与Al(OH)3反应的离子反应方程式 。
(3)画出B的原子结构简图 ___________________。
(4)电子式表示化合物 C2D 的形成过程: 。
法国化学家V.Grignard,所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成。Grign ard试剂的合成方法是:RX+Mg
ard试剂的合成方法是:RX+Mg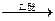 RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路如下,H的一氯代物只有3种。
(1)F的结构简式是;
(2)C+D→E的反应类型是,F→G的反应类型是;
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B,
I→J。
(4)I 和该二元酸除了能反应生成J外,还可以在一定条件下发生缩聚反应生成高聚物,试写出此高聚物的结构简式 。
和该二元酸除了能反应生成J外,还可以在一定条件下发生缩聚反应生成高聚物,试写出此高聚物的结构简式 。