A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图17 (反应条件和部分产物略去)。试回答:
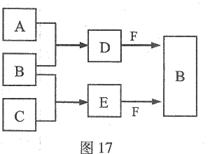
(1)E的电子式是 。
(2)单质X和B或D均能反应生成黑色固体Y,Y的化学式是 。
(3)物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是 。
(4)取0.3 mol F与足量D充分混合后,所得溶液中再通入0.2 mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+) 。
(5)E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是 。(已知甲醇的燃烧热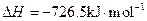 ,氢气的燃烧热
,氢气的燃烧热 )
)
不同金属离子在溶液中完全沉淀时,溶液的pH不同。
| 溶液中被沉淀的离子 |
Fe3+ |
Fe2+ |
Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH |
≥3.7 |
≥6.4 |
≥4.4 |
氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。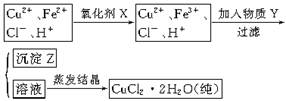
⑴下列氧化剂中最适合作氧化剂X的是(填序号);
A.NaClO B.H2O2 C.KMnO4 D.HNO3
⑵物质Y的化学式是;
⑶写出沉淀Z在水中的沉淀溶解平衡方程式:。
(1)常温下,0.1 mol/L的醋酸和0.1 mol/L的盐酸各100 mL,分别与足量的锌粒反应,产生的气体体积前者__________后者(填“<”“>”或“=”)。
(2)写出泡沫灭火器反应原理(用离子方程式表示):。
(3)医院里用HgCl2的稀溶液作手术刀的消毒剂。HgCl2熔融时不导电,熔点低。HgS难溶于水和稀的强酸却易溶于饱和的NaCl溶液中。试推测HgCl2是化合物(填“离子”或“共价”),是电解质(填“强”或“弱”)。
(4)水是一种极弱的电解质,在常温下平均每n个水分子只有1个分子发生电离,n的值是。
下列各组物质中括号中为杂质,请填写除去杂质所用的试剂及反应的离子方程式:
(1).NaHCO3溶液(Na2CO3),用__________试剂,离子方程式___________。
(2).CO2(HCl),用___________ 试剂,离子方程式。
某溶液中含有OH-、CO32-、SO42-三种阴离子,如果只取一次溶液分别将三种离子检验出来,那么:
(1)先检验,加入试剂(或溶液)。
(2)再检验,加入试剂(或溶液)。
(3)最后检验,加入试剂(或溶液)。
在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,是氧化剂;元素被氧化;是氧化产物;被还原的HNO3与参加反应的HNO3物质的量之比是。