硫酸试剂瓶标签上的部分内容如图。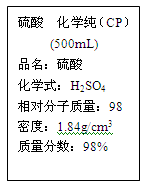
据此回答下列问题:
(1)该硫酸的物质的量浓度为 mol/L。
(2)配制250mL 0.50mol·L-1的稀硫酸需取该硫酸 mL。
(3)配制时必需的玻璃仪器有: 。
(4)定容时,若加入的水超过刻度线,必须采取的措施是 。
(5)下列操作会使所配溶液浓度偏低的是 。
| A.转移溶液时,未洗涤烧杯 |
| B.容量瓶用蒸馏水洗净后仍残留蒸馏水 |
| C.定容时,俯视容量瓶的的刻度线 |
| D.定容摇匀后,发现液面低于刻度线,再加水至刻度线 |
有一透明溶液,可能含有Al3+、Fe3+、K+、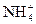 、Mg2+和Cu2+等离子中的一种或几种。现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。如加入Na2O2的量与生成白色沉淀的量之间的关系用右图来表示。试推断:
、Mg2+和Cu2+等离子中的一种或几种。现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。如加入Na2O2的量与生成白色沉淀的量之间的关系用右图来表示。试推断:
(1)原溶液中一定含有___________离子。
(2)一定不含有___________离子。
(3)可能含有___________离子。
(4)为了进一步确定可能含有的离子,应增加的实验操作为___________。
某无色透明溶液A,是由H+、Ba2+、Mg2+、OH-、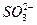 、
、 、
、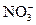 、Cl-中的若干离子组合而成的,它能与铝作用只放出H2,试分为酸性、碱性两种情况讨论其组成。
、Cl-中的若干离子组合而成的,它能与铝作用只放出H2,试分为酸性、碱性两种情况讨论其组成。
(1)若A溶液呈明显的酸性,则除H+外,溶液中还可能有显著量的_________、_________、_________离子。
(2)若A溶液呈明显的碱性,则除OH-外,溶液中还可能有显著量的_________、_________、_________离子。
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的转化: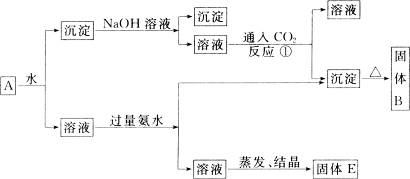
据此判断:
(1)固体B所含物质的化学式为_______________________________。
(2)固体E所含物质的化学式为_______________________________。
(3)反应①的离子方程式为____________________________________。
取一根镁条置于坩埚内点燃,得到氧化镁和氮化镁的混合物的总质量为0.470 g,冷却后加入足量水,再将溶液蒸干并灼烧得到氧化镁0.486 g,按要求完成下列问题:
(1)氮化镁的电子式____________________________。
(2)混合物中加入水的反应方程式____________________________。
(3)燃烧产物中氧化镁的质量分数____________________________。
(4)镁燃烧生成氧化镁和氮化镁时,共转移电子____________________________mol。
把河沙跟镁粉按一定质量比例混合均匀(15∶24),装入试管中加热,大约1 min发生剧烈反应,待生成的混合物冷却后放入盛有稀硫酸的烧杯中,即产生气泡,并伴有爆鸣声,产生一种气态氢化物。
(1)写出河沙跟镁粉在加热条件下反应的方程式,并标明是放热还是吸热:____________
_______________________________________________________________________________。
(2)写出生成的混合物放入稀硫酸中发生反应的方程式:____________________________。
(3)写出产生“爆鸣声”的化学方程式:__________________________________________。