在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:
3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M
关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3
②还原性:Cl->As;
③每生成1molAs,反应中转移电子的物质的量为3mol;
④ M为OH-;
⑤ SnCl62-是氧化产物。
| A.只有①③ | B.①③⑤ | C.①②③④ | D.①②④⑤ |
某溶液中有Fe2+、Mg2+、Al3+、Fe3+等四种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,,溶液中大量减少的阳离子是
| A.Fe2+ | B.Mg2+ | C.Al3+ | D.Fe3+ |
下列有关金属的工业制法中,正确的是
| A.制钛:用金属钠置换氯化钛(TiCl4)溶液中的钛 |
| B.炼铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中的铁 |
| C.制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 |
| D.炼铜:用黄铜矿(主要成分为CuFeS2)直接电解精炼得到纯度为99.9%的铜 |
下列离子方程式的书写正确的是
| A.铁和稀硝酸反应:Fe + 2H+ = H 2↑+ Fe 2+ |
| B.NaHCO3溶液与NaOH溶液反应: OH- + HCO3-= CO32-+ H2O |
| C.氯化铝溶液与足量氨水反应:Al3++ 4OH-=AlO2-+2H2O |
| D.硫酸铜溶液与氢氧化钡溶液反应:Cu2++2OH-=Cu(OH)2↓ |
在CuO和Fe粉的混合物中,加入一定量的稀硫酸,并微热,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,发现铁钉并无任何变化。根据上述现象,确定下面结论正确的是()
| A.不溶物一定是Cu | B.不溶物一定含铜,但不一定含铁 |
| C.不溶物一定是Fe | D.溶液中一定含有Fe2+,但不一定含有Cu2+ |
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子可能是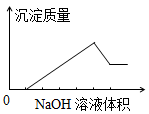
| A.Mg2+、Al3+、Fe3+ | B.Na+、Mg2+、Al3+ |
| C.H+、Ba2+、Al3+ | D.H+、Mg2+、Al3+ |