下列实验方案中,可行的是
| A.按溶解、过滤、蒸发的操作顺序分离CaCl2、CaCO3的混合物 |
| B.将白醋滴在润湿的pH试纸上,测定其pH |
| C.用氢氧化钠溶液除去CO2中的HCl气体 |
| D.用BaCl2溶液除去KNO3溶液中少量的K2SO4 |
在不同温度下,向2L密闭容器中加入1molNO和1mol活性炭,发生反应: 2NO(g)+C(g) N2(g)+CO2(g)△H="-213.5kJ" mol-1,达到平衡时的数据如下:
N2(g)+CO2(g)△H="-213.5kJ" mol-1,达到平衡时的数据如下:
| 温度/℃ |
n(活性炭)/mol |
n(CO2)/mol |
| T1 |
0.70 |
|
| T2 |
0.25 |
下列说法不正确的是
A.上述信息可推知:T1<T2
B.T1℃时,该反应的平衡常数K=9/16
C.T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减
D.T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变
用四种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是
| 选项 |
操作及现象 |
溶液 |
| A |
通入CO2,溶液变浑浊 |
饱和Na2CO3溶液 |
| B |
通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 |
Na2SiO3溶液 |
| C |
通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 |
Ca(ClO)2溶液 |
| D |
通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 |
澄清石灰水 |
如右图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是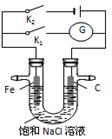
| A.K1闭合,铁棒上发生的反应为2H++2e-=H2↑ |
| B.K1闭合,石墨棒周围溶液pH逐渐升高 |
| C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
| D.K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体 |
下列说法正确的是
| A.含4molHCl的浓盐酸与足量MnO2充分反应,转移2NA个电子 |
B.500℃、30MPa下,将0.2mol N2和0.6molH2置于密闭的容器中反应生成NH3(g),反应达到平衡时放出的热量为7.72kJ,其热化学方程式为: △H=-38.6kJ·mol-1 △H=-38.6kJ·mol-1 |
C.对于可逆反应 △H﹤0,升高温度,可使反应速率增大,反应逆向移动 △H﹤0,升高温度,可使反应速率增大,反应逆向移动 |
| D.元素原子的最外层电子数的多少与其非金属性的强弱无必然联系。 |
在100 mL含等物质的量的HBr和H2SO3的溶液中通入0.025 mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。则原溶液中HBr和H2SO3的浓度都等于
| A.0.16 mol·L-1 | B.0.02 mol·L-1 | C.0.20 mol·L-1 | D.0.25 mol·L-1 |